Química 10º 1
Q U Í M I C A 10º
MAURICIO MUÑOZ MATEMÁTICO FÍSICO UNIVALLE
La química es la ciencia que estudia la materia: su composición, su estructura, sus propiedades y sus cambios.
Materia
Es todo aquello que tiene masa y ocupa un espacio.
Todos los objetos están constituidos de materia, aunque se diferencian entre si por poseer características especiales llamadas propiedades, las cuales explican diversidad de sustancias.
Que es la composición
La composición de una sustancia incluye tanto la identidad como la cantidad de sus componentes.
| Composición del agua | |
Identidad | Cantidad |
Oxigeno | 88.88% |
Hidrógeno | 11.12% |
Que es la estructura
Los componentes de una sustancia determinada se distribuyen de una forma especial, dicho arreglo toma el nombre de estructura.
Propiedades de la materia
Las propiedades de la materia son útiles cuando se desea distinguir entre las diferentes sustancias. Estas propiedades se clasifican en físicas y químicas.
Las propiedades físicas son aquellas que pueden observarse o medirse sin variar ni la composición ni la estructura de una sustancia.
El color, el olor y la densidad son propiedades físicas.
Las propiedades químicas involucran cambios en la composición y en la estructura, que ocurren cuando la sustancia se somete a diferentes condiciones.
La inflamabilidad es una propiedad química: para determinarla es necesario someter una sustancia a la combustión. Al hacerlo, cambia la composición: se forma nuevas sustancias.
CAMBIOS DE LA MATERIA
Se consideran cambios de la materia toda transformación física o química que se presenta en una materia.
Cambios físicos
Cambios que sufren la materia en su estado. Volumen o forma sin alterar su composición.
La transformación del hielo en agua constituye un cambio físico.
Cambios químicos
En estos cambios, la naturaleza de la materia sufre variaciones en la composición.
Estos cambios son reacciones químicas en la cuales influyen factores como la luz, la presión, los reactivos y los catalizadores. La combustión de un trozo de papel es un cambio químico.
Materia y energía
La energía es la capacidad para realizar un trabajo. La relación entre materia y energía fue establecida por Albert Einsten en la ecuación para la conservación de la energía:
E =mc2
En donde m = masa
c=velocidad de la luz 3 x 1010 cm / s.
E= Energía.
División de la química
La química se divide en varias ramas, cada una de las cuales estudia un campo especializado: Química general, Química inorgánica, Química orgánica, Bioquímica, fisicoquímica, bioquímica y química nuclear.
PREGUNTA. ¿Qué es la materia?
* Todo aquello que no pesa * Todo aquello que tiene volumen
* Todo aquello que tiene masa y ocupa espacio
EL METODO CIENTIFICO

La química es una ciencia experimental, lo cual significa que sus principios y leyes:
a. Provienen de la experimentación
b. Son demostrables en la práctica
c. Tienen aplicación de orden práctico
“Todo cuerpo sumergido en un fluido, sufre una disminución aparente de su peso “. Este principio puede demostrarse experimentalmente: basta introducir una piedra en agua para verificarlo.
Los barcos, los submarinos, los aviones y los globos son aplicaciones de orden práctico del mismo.
Que es el método científico
El método científico es un proceso de investigación que se puede dividir en las siguientes etapas:
Planteamiento del problema
Formulación de hipótesis y predicciones
Experimentación y recopilación de datos
Interpretación de datos y conclusiones
Cada uno de estas etapas incluye los llamados procesos de la ciencia, que son un conjunto de habilidades indispensables para todas las personas dedicadas a ellas: observar, medir, predecir, experimentar, comunicar y formular principios y leyes, entre otros.
Características del método científico
El método científico proporciona los medios necesarios para probar si una afirmación es o no valida.
Si alguien afirma que ha descubierto un nuevo elemento químico, no basta la afirmación: es necesario demostrarla. Con este fin tendría que diseñar experimentos donde se ponga de manifiesto las proporciones del elemento descubierto.
El método científico debe usar todas las pruebas que tenga relación con el fenómeno que se investiga.
Un científico no solo se vale de un punto de vista, sino del de los demás. No trata de probar que él tiene razón: busca ante todo la verdad.
El método científico supone un análisis adecuado de los resultados obtenidos y de las técnicas empleadas.
Las técnicas de medición hacen necesario un estudio: ¿cuál es su precisión? , ¿Son buenos los instrumentos? Los análisis requieren un rigor lógico, porque de lo contrario, la investigación se invalida y las conclusiones ya no serán fiables.
El método científico requiere de honradez intelectual
La persona que hace ciencia debe aceptar sus errores y fracasos. Sus conclusiones debe plantearlas como aproximaciones a la verdad, y sin pretensiones de dogma.
Que es una teoría
Una teoría es una asociación de leyes que en conjunto explican un hecho determinado.
Una teoría es válida si es respaldada por un cuerpo teórico y experimental y además constituye un aporte a la profundización del conocimiento.
Que es un modelo
El modelo es la representación concreta de una teoría mediante un sistema físico conocido y bien estudiado.
Cuando un científico formula una nueva teoría, construye un modelo de ella para que las demás personas la comprendan con facilidad.
Ten presente que los modelos científicos:
Representen una idea o concepción teórica sobre la naturaleza de algún objeto o fenómeno.
Permiten en un momento determinado, explicar el comportamiento de dicho objeto o fenómeno.
Favorecen la formulación de predicciones que conduzcan al diseño de experimentos u observaciones, como prueba de su validez.
Evolucionan paralelamente con el conocimiento científico, modificándose o remplazándose por nuevos modelos.
Pregunta ¿Que es un modelo?
* Es la demostración de que una teoría si funciona.
* Es un proceso de investigación.
* Es una asociación de leyes que en conjunto explican un hecho
determinado.
* Es la representación concreta de una teoría.
Clasificación de la Materia
La materia la podemos encontrar en la naturaleza en forma de sustancias puras y de mezclas.
Las sustancias puras : Es un material homogéneo constituido por una sola sustancia.
Se dividen en dos grandes grupos: Elementos y Compuestos.
Elementos: Son sustancias puras que no pueden descomponerse en otras sustancias puras más sencillas por ningún procedimiento. Ejemplo: Todos los elementos de la tabla periódica: Oxígeno, hierro, carbono, sodio, cloro, cobre, etc. Se representan en la tabla periódica mediante su símbolo químico (O, Fe, C, Na, Cl, Cu, etc.) y se conocen 115 en la actualidad.
Compuestos: Son sustancias puras que están constituidas por 2 ó más elementos combinados en proporciones fijas. Los compuestos se pueden descomponer mediante procedimientos químicos en los elementos que los constituyen. Ejemplo: Agua, de fórmula H2O, está constituida por los elementos hidrógeno (H) y oxígeno (O) y se puede descomponer en ellos mediante la acción de una corriente eléctrica (electrólisis). Los compuestos se representan mediante fórmulas químicas en las que se especifican los elementos que forman el compuesto y el número de átomos de cada uno de ellos que compone la molécula. Ejemplo: En el agua hay 2 átomos del elemento hidrógeno y 1 átomo del elemento oxígeno formando la molécula H2O.
Las mezclas se encuentran formadas por 2 ó más sustancias puras. Su composición es variable. Se distinguen dos grandes grupos: Mezclas homogéneas y Mezclas heterogéneas.
Mezclas homogéneas: También llamadas Disoluciones. Son mezclas en las que no se pueden distinguir sus componentes a simple vista. Ejemplo: Disolución de sal en agua, el aire, una aleación de oro y cobre, etc.
Mezclas heterogéneas: Son mezclas en las que se pueden distinguir a los componentes a simple vista. Ejemplo: Agua con aceite, granito, arena en agua, etc.
En el material heterogéneo se observan distintas fases:
Fase: es una región de materiales que tiene propiedades diferentes de aquellas de las regiones vecinas.
En un sistema constituido por un vaso con agua y hielo, existen: la fase del vidrio, la fase del agua, la fase del hielo y la fase del aire.
Los componentes de un material heterogéneo forman mezclas mecánicas, las cuales se pueden separar por medios físicos
Los procedimientos físicos más empleados para separar los componentes de una mezcla heterogénea son: la filtración, la decantación y la separación magnética. Estos métodos de separación son bastante sencillos por el hecho de que en estas mezclas se distinguen muy bien los componentes.
- Filtración: Este procedimiento se emplea para separar un líquido de un sólido insoluble. Ejemplo: Separación de agua con arena. A través de materiales porosos como el papel filtro, algodón o arena se puede separar un sólido que se encuentra suspendido en un líquido. Estos materiales permiten solamente el paso del líquido reteniendo el sólido.
- Decantación: Esta técnica se emplea para separar 2 líquidos no miscibles entre sí. Ejemplo: Agua y aceite. La decantación se basa en la diferencia de densidad entre los dos componentes, ambos se separan hasta situarse el más denso en la parte inferior del envase que los contiene. De esta forma, podemos vaciar el contenido por arriba (si queremos tomar el componente menos denso) o por abajo (si queremos tomar el más denso).
En la separación de dos líquidos no miscibles, como el agua y el aceite, se utiliza un embudo de decantación que consiste en un recipiente transparente provisto de una llave en su parte inferior. Al abrir la llave, pasa primero el líquido de mayor densidad y cuando éste se ha agotado se impide el paso del otro líquido cerrando la llave. La superficie de separación entre ambos líquidos se observa en el tubo estrecho de goteo.
Una disolución es una mezcla homogénea formada por 2 ó más sustancias puras en proporción variable. Las disoluciones pueden ser binarias (2 componentes), ternarias (3 componentes), etc. Ejemplo: Una mezcla de agua con sal es una disolución.
El componente de la disolución que se encuentra en mayor cantidad se llama disolvente y el o los que aparecen en menor cantidad se llaman solutos. Ejemplo: En una disolución de sal en agua, la sal es el soluto y el agua es el disolvente.
Pregunta: Las soluciones en donde no se pueden distinguir sus componentes, se denomina:
* Heterogénea. * Homogénea. * Sustancias puras
Propiedades de la materia - Unidades de media
Existen propiedades que permiten conocer y diferenciar una sustancia de otra, las cuales se pueden clasificar en propiedades químicas y propiedades físicas.
Las propiedades químicas de las sustancias son aquellas que ponen de manifiesto cuando se transforma en otras, Por ejemplo la capacidad de combustión es una de ellas.
Las propiedades físicas pueden ser específicas o extensivas:
Propiedades específicas
1. Las propiedades organolépticas , donde se identifican las sustancias utilizando los sentidos , tal como el color, olor, sabor, solubilidad , brillo, transparencia , dureza.
2. Las propiedades intensivas que no depende de la cantidad de sustancias analizada, por ejemplo, densidad, punto de fusión, punto de ebullición, conductividad eléctrica y conductibilidad del calor.
Propiedades extensivas
Estas dependen de la cantidad de sustancia analizada por ejemplo, volumen, peso, masa, tamaño.
Para medir estas propiedades se emplean magnitudes como: longitud, volumen, masa, tiempo, temperatura, cantidad de sustancia (n) y otros.
Unidades básicas en el sistema internacional, SI
Cantidad | Unidad | Símbolo |
Longitud | Metro | m |
Masa | Kilogramo | Kg |
Tiempo | Segundo | s |
Corriente eléctrica | Amperio | A |
Temperatura | Kelvin | K |
Cantidad de sustancia | mol | mol |
Intensidad luminosa | candela | cd |
Otras magnitudes se pueden obtener de las unidades básicas por multiplicación o división de una o más unidades.
Volumen: Para calcular el volumen hay que elevar la longitud al cubo ( I3 ) , largo, ancho , alto = I3 ; por lo tanto la unidad de volumen es igual al metro cúbico ( m3 ). Como el metro cúbico es una unidad demasiado grande , en su lugar se emplea el decímetro cúbico ( dm3 ), el centímetro cúbico ( cm3 ); la unidad de volumen mas común en química es el litro ( l).
1 litro = 1000 cm3 = 1.000.000 mm3
1 metro cúbico = 1.000 dm3
Ejemplo:
Convertir 10 m3 a cm3
Sabemos que 1m3=1.000 Litros. Aplico una regla de tres simple para hallar cuantos litros equivalen a 10 m3.

Entonces: 10 m3=10.000 Litros. Sabemos que 1 Litro = 1.000 cm3
Realizamos una regla de tres simple para hallar cuantos cm3 equivalen 10.000 Litros, lo que es igual a 10 m3.

Entonces: 10.000 Litros = 10.000.000 cm3. Como 10 m3= 10.000 Litros, entonces 10 m3= 10.000.000 cm3
Densidad: Es la masa de una sustancia por unidad de volumen. Se calcula dividiendo la masa por su volumen. Se expresa en g/ cm3 para sólidos y líquidos y en g/ml para gases.
Densidad = masa por unidad de volumen
D= masa de la sustancia / Volumen de la sustancia
Por lo tanto :
D = m/v
La temperatura y su medición
La temperatura es la magnitud que contempla el contenido calórico de un cuerpo; depende del promedio de la vibración de las moléculas.
Para medir la temperatura se usan varias escalas: Celsius, Fahrenheit, Kelvin, Ranking, las mas utilizada es la escala Celsius llamadas también centígrados (ºC).
CELSIUS (°C)
En esta escala, al punto de solidificación del agua se le asigna un valor de cero grados, y al punto de ebullición un valor de 100 grados a 1 atmósfera de presión. El espacio en estos valores se divide en 100 partes iguales, correspondiendo cada una de estas divisiones a 1° C; los espacios por encima de 100 y por debajo de 0 están divididos en unidades del mismo valor.
KELVIN (ºK)
El punto de solidificación del agua se le asigna un valor de 273° k y al de ebullición 373° k, entre estos dos valores se hacen 100 divisiones equivalentes a 1°k. Esta escala también se denomina escala absoluta por que no tiene valores negativos de temperatura.
Las escalas kelvin y celsius difieren unicamente en la elección de punto cero. se toma como cero en la escala absoluta de kelvin el cero absoluto de temperatura equivalente a - 273° c.
0 ºK= - 273 ºC
Temperatura Kelvin = 273 + temperatura Celsius
ºK = 273 + ºC
FAHRENHEIT (ºF)
En la escala Fahrenheit, el punto de congelación del agua es de 32 grados, y el de ebullición es de 212 grados; el espacio entre estos valores se divide en 180 partes, cada uno de los cuales corresponde a 1º F.
Como el espacio comprendido entre el punto de ebullición y el punto de congelación del agua esta dividido en 100 intervalos en la escala Celsius y 180 en la escala Fahrenheit, es logico que 100 intervalos Celsius equivalen a 180 intervalos Fahrenheit, o sea que:
100 ºC = 180 ºF
Ahora bien, el punto de congelación del agua es 0º en la escala Celsius y 32º en
0 ºC = 32 ºF
Por lo tanto:
Temperatura Fahrenheit = 9/5 (Temperatura Celsius) + 32
ºF = (9/5) ºC + 32
Temperatura Celsius = 5/9 (temperatura Fahrenheit – 32)
ºC = 5/9 (ºF – 32)
RANKINE (ºR)
Se denomina Rankine a la escala de temperatura que se define midiendo en grados Fahrenheit sobre el cero absoluto, por lo que carece de valores negativos.
El grado Rankine tiene su punto de cero absoluto a −459,67°F y los intervalos de grado son idénticos al intervalo de grado Fahrenheit. La relación entre la temperatura en grados Rankine (°R) y la temperatura correspondiente en grados (°F) Fahrenheit es:
ºR = ºF + 459.67
ºF = ºR - 459.67
Cero grados Rankine (0 °R) equivalen a −273,15 °C ó 0 K. Para convertir de grados Rankine a Kelvin se multiplica por un factor de 9/5:
ºR = (9/5) ºK
ºK = (5/9) ºR
ºR = (9/5) ºC + 491.67
ºC = 5/9 (ºR - 491.67)
- PROBLEMAS RESUELTOS
Convertir 30 °C y -6 °C en grado Kelvin
Temperatura Kelvin = temperatura centígrada + 273
· 30 °C a °K
°K = 30 + 273 = 303 °K
· -6 °C a °K
°K = -6 + 273 = 267 °K
Convertir 40 °K y 450 °K a grados centígrados
· 40°K a °C
°C= 40-273 = -233 °C
· 450 °K a °C
°C = 450 -273 = 177 °C
Expresar -66 °F en grado Rankine y grados Kelvin
Temperaturas Rankie: temperatura Fahrenheit + 460
· -66 °F a °R
°R= -66 + 460 = 394 °R
Temperatura Kelvin = 5/9 x Temperatura Rankine
· 394 °R a °K
°K= 5/9 × 394 °R = 219 °K
Pregunta: Convertir 100 °F a °C:
a) 205 °C b) 57
°C c) 37 °C
Relación entre átomo - mólecula-elemento -compuesto
RELACIÓN ENTRE ÁTOMO – MOLÉCULA – ELEMENTO – COMPUESTO
Molécula
La molécula es la unidad más pequeña de sustancia pura capaz de existir independientemente y en forma estable, la molécula es el límite de la subdivisión física.
Una gota de agua está constituida por millones de unidades o moléculas.
Átomo
Los átomos son las unidades a partir de las cuales se forman las moléculas.
Una molécula está compuesta por dos o más átomos. Los átomos constituyen una molécula se pueden separar por métodos químicos.
La molécula de agua está constituida por tres átomos: un átomo de oxigeno y dos de hidrógeno.
La división química de una molécula en moléculas más pequeñas o en átomos, produce cambios en la composición y por lo tanto, cambios en las propiedades. Así una molécula de azúcar común o sacarosa, puede romperse químicamente en dos moléculas: una de glucosa y una de fructuosa. La glucosa y la fructuosa también son azucares pero con propiedades diferentes a las de las sacarosa.
Las sustancias puras se clasifican en elementos o compuestos, según la clase de átomos que formen la molécula.
Elemento
Un elemento es una sustancia pura cuyas moléculas están formadas por una sola clase de átomos.
Compuesto
Un compuesto es una sustancia pura cuya molécula está formada por dos o más clases de átomos. Por métodos químicos un compuesto se descompone en compuestos más simples o en elementos, son compuestos el agua, la sacarosa, la isulina, entre otros.
Descubrimiento de los elementos químicos
En 1860 los científicos ya habían descubierto más de 60 elementos diferentes y habían determinado su masa atómica. Notaron que algunos elementos tenían propiedad química similar por lo cual le dieron un nombre a cada grupo de elementos parecidos. En 1829 el químico J.W. Döbenreiner organizó un sistema de clasificación de elementos en el que éstos se agrupaban en grupos de tres denominados triadas. La propiedades químicas de los elementos de una triada eran similares y sus propiedades físicas variaban de manera ordenada con su masa atómica. Algo más tarde, el químico ruso Dmitri Ivanovich Mendeleyev desarrolló una tabla periódica de los elementos según el orden creciente de sus masas atómicas. Colocó lo elementos en columnas verticales empezando por los más livianos, cuando llegaba a un elemento que tenía propiedades semejantes a las de otro elemento empezaba otra columna. Al poco tiempo Mendeleiev perfecciono su tabla acomodando los elementos en filas horizontales. Su sistema le permitió predecir con bastante exactitud las propiedades de elementos no descubiertos hasta el momento. El gran parecido del germanio con el elemento previsto por Mendeleyev consiguió finalmente la aceptación general de este sistema de ordenación que aún hoy se sigue aplicando.
Sin embargo, la tabla de Mendeleiev no era del todo correcta. Después de que se descubrieron varios elementos nuevos y de que las masas atómicas podían determinarse con mayor exactitud, se hizo evidente que varios elementos no estaban en el orden correcto. La causa de este problema la determinó el químico inglés Henry Moseley quien descubrió que los átomos de cada elemento tienen un número único de protones en sus núcleos, siendo el número de protones igual al número atómico del átomo. Al organizar Moseley los elementos en orden ascendente de número atómico y no en orden ascendente de masa atómica, como lo había hecho Mendeleiev, se solucionaron los problemas de ordenamiento de los elementos en la tabla periódica. La organización que hizo Moseley de los elementos por número atómico generó un claro patrón periódico de propiedades.
Símbolo
Es la letra o las dos letras que se emplean para representar los elementos químicos.
La letras del símbolo se tomaron del nombre del elemento:
Carbono: C
Potasio: K
Sodio: Na
De la unión de los elementos se obtiene los compuestos. Los compuestos se representan mediante formulas.
Fórmula
La fórmula indica la clase y la cantidad de átomos que forman la molécula de un compuesto.
Hay fórmulas que indican las manera en que están enlazados los átomos para formar el compuesto. En este caso la fórmula se llama estructural o simplemente estructura.
H2O = Fórmula molecular
Pregunta. ¿A qué se le denomina, conjunto de átomos iguales?
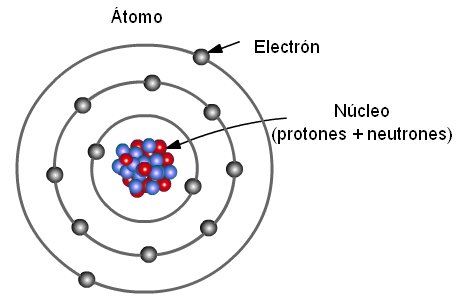
Modelo Atómico de la materia
La materia está constiuida por partículas
indivisbles llamadas átomos.
Mucho tiempo hubo que trascurrir para establecer el modelo atómico de la materia. Desde cinco siglos antes de Cristo , los pensadores griegos se dividían en dos grupos : Lo que afirmaban que la materia era continua y los que aseguraban que la materia era discontinua.
Materia continua quiere decir que se
puede dividir indefinidamente.
Una partícula de hierro , por ejemplo, por pequeña que sea, puede ser dividida en otras más pequeñas, sin límite y cualquiera de esas partículas tiene las propiedades que caracterizan al hierro.
Esta concepción está en incapacidad de explicar la diferencia de propiedades entre los elementos químicos , hierro y oro , por ejemplo.
Materia discontinua quiere decir que existe
un limite en la división
Al dividir el hierro llega un momento en que se logra unas partículas últimas , indivisibles . Dichas partículas son los átomos. Si se admite que que la materia es discontinua, perfectamente se puede explicar las diferencias entre los elementos químicos : al dividir el hierro y el oro, cada caso se llegara a particulas últimas indivisibles , que tendrán diferentes tamaño , masa , forma , distribución.
EL RAZONAMIENTO DE DÉMOCRITO Y LEUCIPO
La escuela filosófica atomista , dirigida por Demócrito y Leucipo en Grecia , cinco siglos antes de Cristo , defendió la discontinuidad de la materia , aunque su idea no fue acompañada de pruebas experimentales . Su razonamiento puede sintatizarse así: Un trozo de metal puede cortarse en dos pedazos y cada uno de estos en otros dos pedazos más ........... ; estos pueden dividirse sucesivamente hasta llegar a un momento en que obtenga una partícual tan pequeña que ya no sea posible dividirla: el átomo.
LA TEORIA ATÓMICA MODERNA
Solamente hacia el año 1800, el profesor inglés Jhon Dalton propone en forma científica la teoría atómica de la materia. A partir de entonces el modelo atómico ha sufrido una serie de cambios.
PREGUNTA: ¿A qué se le denomina particula indivisible?
Partículas subatómicas fundamentales
El átomo posee tres partículas fundamentales:
particulas masa carga lugar del átomo símbolo
protón 1 U 1+ Núcleo p,+
neutrón 1 U 0 Núcleo n,o
electrón 1/1840 U 1- Corteza e-,
El núcleo del átomo está formado por protones y neutrones. Por estar localizados en el núcleo, estas partículas se llaman Nucleones.
PROTONES
Los protones son nucleones de masa 1 que tienen la carga positiva (+) más pequeña obtenida y medida por el hombre.
Los protones se hallan en el núcleo del átomo y de su número depende la carga nuclear.
Un átomo con 3 protones en el núcleo, tiene una carga nuclear de 3 +.
A su vez, un átomo cuya carga nuclear es 15 + , tendrá 15 protones en su núcleo. De la carga nuclear de un átomo depende su Número atómico.
ELECTRONES
Son partículas subatómicas de masa insignificante, portadores de la carga eléctrica negativa más pequeña obtenida y medida por el hombre.
Los electrones confieren volumen al átomo, participan en su carga pero no aportan masa.
La masa del electrón es tan pequeña que corresponde a 1/1840 de la masa del protón o del neutrón. Esto quiere decir, que si en uno d elos platillos de una balanza micróscopica imaginaria colocamos un protón, para equilibrarla en el otro platillo debemos colocar 1840 electrones.
Si quitamos el protón de la balanza y en su lugar colocamos un neutrón, la balanza seguiría en equilibrio.
De los conceptos anteriores se puede deducir que la masa del átomo depende prácticamente de la masa del núcleo ya que en él se localizan las particulas que tienen masa representativa.
MASA NUCLEAR
Es la masa del núcleo y es igual a la suma de protones y neutrones.
MASA ATOMICA (A).
NUMERO ATÓMICO (Z)
El número atómico de un atómo es igual al número de protones que lleva en su núcleo.
El número atómico se representa por la letra Z.
Para encontrar el Z de un elemento, se recurre a la tabla periódica. El número de orden de los elementos en la tabla periódica.
El elemento flúor (f), número 9 en la tabla periódica, por lo tanto su número atómico (z) es igual a 9. En consecuencia, el fluor tendrá 9 protones en su núcleo y una carga nuclear de 9 +.
Todos los átomos que tengan la misma carga nuclear o el mismo número atómico pertenecen a un mismo elemento.
Por ejemplo, los atómos que tengan un solo protón en el núcleo serán átomos de hidrógeno ( z=1).
ELEMENTOS DE OXÍGENO:
ELEMENTO Oxigeno | Símbolo O | Cantidad de protones (p+) =8 p+ | Cantidad de electrones (e-)=8 e- | Cantidad de neutrones (n)= 8 n | Carga nuclear: 8 + | Numero atómico (z) : 8 | Masa nuclear : 16 U | Masa atómica (A): 16 U |
Pregunta. La masa atómica es:
* La suma de protones y neutrones. * El total de electrones. * El mismo número Z.
El modelo del átomo, hoy.
En física y química, átomo (del latín atomus, y éste del griego άτομος, indivisible) es la unidad más pequeña de un elemento químico que mantiene su identidad o sus propiedades y que no es posible dividir mediante procesos químicos.
El concepto de átomo como bloque básico e indivisible que compone la materia del universo ya fue postulado por la escuela atomista en la Antigua Grecia. Sin embargo, su existencia no quedó demostrada hasta el siglo XIX. Con el desarrollo de la física nuclear en el siglo XX se comprobó que el átomo puede subdividirse en partículas más pequeñas.
El modelo actual del átomo se diferencia totalmente del modelo antiguo: hoy los átomos no son indivisibles ni macizos, como pensaba Demócrito. Por el contrario, son la suma de varias partículas y la mayor parte de su interior está vacio.
Estructura del átomo
En el átomo distinguimos dos partes: el núcleo y la corteza.
-El núcleo es la parte central del átomo y contiene partículas con carga positiva, los protones, y partículas que no poseen carga eléctrica, es decir son neutras, los neutrones. La masa de un protón es aproximadamente igual a la de un neutrón. Todos los átomos de un elemento químico tienen en el núcleo el mismo número de protones. Este número, que caracteriza a cada elemento y lo distingue de los demás, es el número atómico y se representa con la letra Z.
Los átomos son eléctricamente neutros, debido a que tienen igual número de protones que de electrones. Así, el número atómico también coincide con el número de electrones.
El diámetro del núcleo es unas 100.000 veces menor que el diámetro del átomo. Esto quiere decir que si el núcleo creciera hasta alcanzar el tamaño de una bola de cristal, el lugar por donde el electrón más cercano pasase con mayor frecuencia estaría a
En realidad el volumen atómico está determinado por el espacio donde se mueven los electrones.
EL NUCLEO ATÓMICO.
El núcleo atómico concentra casi la totalidad de la masa atómica. Antes se creía que era macizo. Sin embargo, también el núcleo está prácticamente vacío; incluso en ciertos casos los electrones pueden penetrar en su interior.
El núcleo está constituido por varias clases de partículas, ligadas por las fuerzas más potentes que se conocen.
Cuando estas partículas se someten a grandes energías y se hacen chocar entre sí, originan otras nuevas, de las cuales se han hallado más de 100 tipos m. Muchas se desintegran en pequeñísimas fracciones de segundo. Son tan altas las tensiones en el interior de los núcleos que, al partirlos se liberan gigantescas cantidades de energía; así aparecen los efectos que se aprovechan en las centrales nucleares o se malgastan en las bombas atómicas. Sin embargo, las partículas más importantes del núcleo son los protones y los neutrones, que se analizarán en forma posterior.
La corteza del átomo está conformada por el espacio donde se mueven los electrones, el cual está prácticamente vacío.
La corteza es la parte exterior del átomo. En ella se encuentran los electrones, con carga negativa. Éstos, ordenados en distintos niveles, giran alrededor del núcleo. La masa de un electrón es unas 2000 veces menor que la de un protón.
PREGUNTA: ¿Cuáles son las partes de un átomo?
* Núcleo y corteza. *
Electrones. * Protones y neutrones. * Ninguna de las anteriores.
El principio de Avogadro
¿CÓMO DIFERENCIAR LAS MOLÉCULAS DE LOS ÁTOMOS?
La teoría cinética molecular afirma que los gases están formados por moléculas muy separadas entre sí que se mueven con distintas velocidades en el volumen donde están contenidas.
Este modelo de los gases explica con facilidad las principales magnitudes que se miden en ellos.Se dicen, por ejemplo, que la presión es el efecto de los choques de las partículas contra las paredes del recipiente, y la temperatura una medida de la velocidad media de las moléculas.
Por otro lado, la teoría atómica afirma que los cambios químicos como la formación de compuestos a partir de los elementos. Se explican suponiendo que los elementos están formados por átomos.
Obsérvense que mientras la teoría cinética molecular habla de moléculas, la teoría atómica se refiere a los átomos.
Esto plantea una serie de interrogantes: Los átomos y las moléculas ¿son iguales o diferentes? si los átomos se unen para formar moléculas, ¿cómo se pueden averiguar cuantos átomos hay en una molécula? ¿En que proporción se combinan los átomos en un caso dado?
Como él oxigeno es un gas, la teoría cinético molecular afirma que está formado por las moléculas. Pero como él oxigeno es a su vez un elemento, la teoría atómica establece que esta formado por átomos. Entonces vale la pena preguntarse: ¿las moléculas de oxígeno son lo mismo que los átomos de oxígeno, son diferentes? si son diferentes, ¿cuál es la diferencia?
La respuesta a estos interrogantes empieza a dislumbrarse en la formulación de la ley de la combinación de los volúmenes.
GAY-LUSSAC Y LA LEY DE LA COMBINACIÓN DE VOLUMENES
En 1808, casi en la misma época en que Dalton propuso la teoría atómica, el científico francés Gay Lussac se interesó en una característica especial de las reacciones entre los gases. El observó que cuando el hidrógeno gaseoso se combina con el oxígeno gaseoso para formar agua, la relación de combinación es siempre de 2 volúmenes de hidrógeno por uno de oxígeno, y el vapor de agua formado ocupara dos volúmenes. Esta y otras observaciones se resumen en el siguiente cuadro:
H
| H
| +
| O
| =
| H2O
|
H
| +
| CI
| =
| HCI
|
|
Gay Lussac resumió estos descubrimientos en su ley de la combinación de los volúmenes, que dice: "los volúmenes de los gases se combinan o se producen en una reacción química están siempre en una relación de los números enteros simples".
AVOGADRO Y LA FORMULACIÓN DE SU PRINCIPIO
En 1811, el científico italiano AMADEO AVOGADRO, basándose en la ley de Gay Lussac publicó un ensayo, en el cual hacia una amplia distinción entre átomos y moléculas. Avogadro explicó magistralmente la razón de ser de la ley de la combinación de los volúmenes, afirmando que ello ocurría porque:
“Los volúmenes iguales de todos los gases a la misma temperatura y presión contiene el mismo numero de moléculas”. Esta afirmación constituye el principio de Avogadro.
RAZONAMIENTO DE AVOGADRO
Así razonó avogadro para explicar la ley de los volúmenes:
a) Experimentalmente se observa que un volumen de hidrógeno se combina con un volumen de cloro para producir dos volúmenes de cloruro de hidrogeno:
H + CI = HCI
B) Lo que ocurre en este caso, decía Avogadro, es que cada molécula de hidrógeno reacciona con una molécula de cloro; la primera molécula de hidrógeno reacciona con una molécula de cloro, la segunda con la segunda, y así sucesivamente hasta que la reacción termine. Al final, se han utilizado todas las moléculas.También, se ha hecho uso de volúmenes iguales de cloro e hidrógeno. Esto llevó a Avogadro a pensar que debía existir alguna reacción entre los números iguales de los gases reaccionantes. La reacción más simple posible ocurrirá cuando volúmenes iguales de todos los gases tengan el mismo número de moléculas a la misma temperatura y presión.
C) El volumen del cloruro de hidrógeno producido es el doble de moléculas de cloruro de hidrógeno de las que había originalmente de hidrógeno o de cloro. En otras palabras: una molécula de hidrogeno y una molécula de cloro se combinan para formar dos moléculas de cloruro de hidrogeno.
H-H + CI-CI = HCI + HCI
D) Cada molécula de cloruro de hidrogeno contiene un átomo de hidrógeno y uno de cloro. Esto llevó a Avogadro a concluir que cada partícula de hidrogeno se había dividido a la mitad, una para cada una de las dos moléculas de cloruro de hidrógeno. De igual manera, cada una de las partículas de cloro se tenía que haber dividido en dos mitades para proporcionar el cloro a las dos moléculas de cloruro de hidrógeno.
Como los átomos no pueden dividirse por medios químicos, Avogadro dedujo que:
Las partículas que forman al hidrógeno gaseoso no pueden ser átomos sencillos, si no que deben contener dos átomos. Estas partículas son las moléculas del hidrógeno.
Idéntico raciocino es válido para el cloro: sus partículas no podían ser átomos sencillos, sino que también debían ser moléculas que contenían dos átomos.
Avogrado había demostrado que la molécula fisica y el atomo no son iguales.
Consecuencias del Principio de Avogadro
Avogadro logró explicar la ley de la combinaciòn de los volumenes en función de las teorias atómicas y molecular, afirmando que: volumenes iguales de gases contienen el mismo nùmero de moléculas. Este era su principal propósito.
Pero además, logró una clara distinción entre moléculas físicas y los átomos químicos, demostrando que, aún una molecula simple podia estar compuesta por dos átomos.
De hecho, se define lo que se llama un mol de un cierto gas como la cantidad de este que hay en 22.4 Litros a 0º y a una atmosfera de presión.
El número de Avogadro, Desde la época de Avogadro, los cientificos han podido determinar el número de moléculas en volumen o masa de un gas.
PREGUNTA: El científico que logró hacer la distinción entre átomos y moléculas fue Amadeo Avogadro: a) fslso b) verdadero
La Mol o la Mole
Se entiende por mol, un número de partículas igual al número de Avogadro.
1 mol = 6,02 × 1023 partículas
La mol es la unidad química de cantidad. Viene de palabra latina moles que significa montón. En realidad, se trata de un montón muy grande, pues el número de Avogadro es una cantidad inmensa.
Un mol de moléculas = 6,02 × 1023 moléculas
Un mol de átomos = 6,02 × 1023 átomos
Un mol de electrones = 6,02 × 1023 electrones.
EL PESO DE LAS MOLECULAS Y EL PESO DE LAS MOLES:
Según el principio de Avogadro, volúmenes iguales de gases iguales a condiciones de presión y temperatura contienen igual número de moléculas.
Así está demostrado que una mol de cualquier gas, a una temperatura de
Sin embargo, al pesar volúmenes iguales de gases, se encuentran que las masa son diferentes . Esto indica que cada gas esta constituido por moléculas especificas.
VOLUMEN MOLAR
Es el volumen ocupado por una mol de moléculas de un gas. A condiciones normales, CN, el volumen molar de cualquier gas es igual a
La masa molecular de un compuesto es la masa de una molécula de dicho compuesto. La masa molecular se expresa en la misma unidad, u, de las masas atómicas.
Para determinar la masa molecular se suman las masas de los átomos que forman la molécula. Cómo establecer la masa molecular del CO2? El gas carbónico tiene un átomo de C y dos de O, en consecuencia su masa molecular es igual a:
Masa debida al carbono:12 × 1 = 12 u
Masa debida al oxígeno: 16 × 2 = 32 u
Masa molecular del gas carbónico = 44u
EL ATOMO – GRAMO
El átomo – gramo del oxígeno es igual a
La molécula – gramo del H2O es igual a
El valor numérico de la molécula – gramo, coincide con el de la masa molecular del compuesto, pero es importante no confundir ambos conceptos: la masa molecular es la masa de una sola molécula y se expresa en unidades de masa atómica (u), mientras que la molécula-gramo es la masa de una mol de moléculas y se expresa en gramos.
Así, la masa molecular del agua es de 18u, mientras que la molécula-gramo es igual a
En el uso corriente, la molécula-gramo es identificada con el término de mol o peso fórmula.
PREGUNTA: La masa molecular del agua es de 18u, mientras que la molécula-gramo es igual a: a) 18U b) 22gr c) 18gramos
Ley Periódica y Tabla Periódica
LA TABLA PERIÓDICA DE LOS ELEMENTOS QUÍMICOS
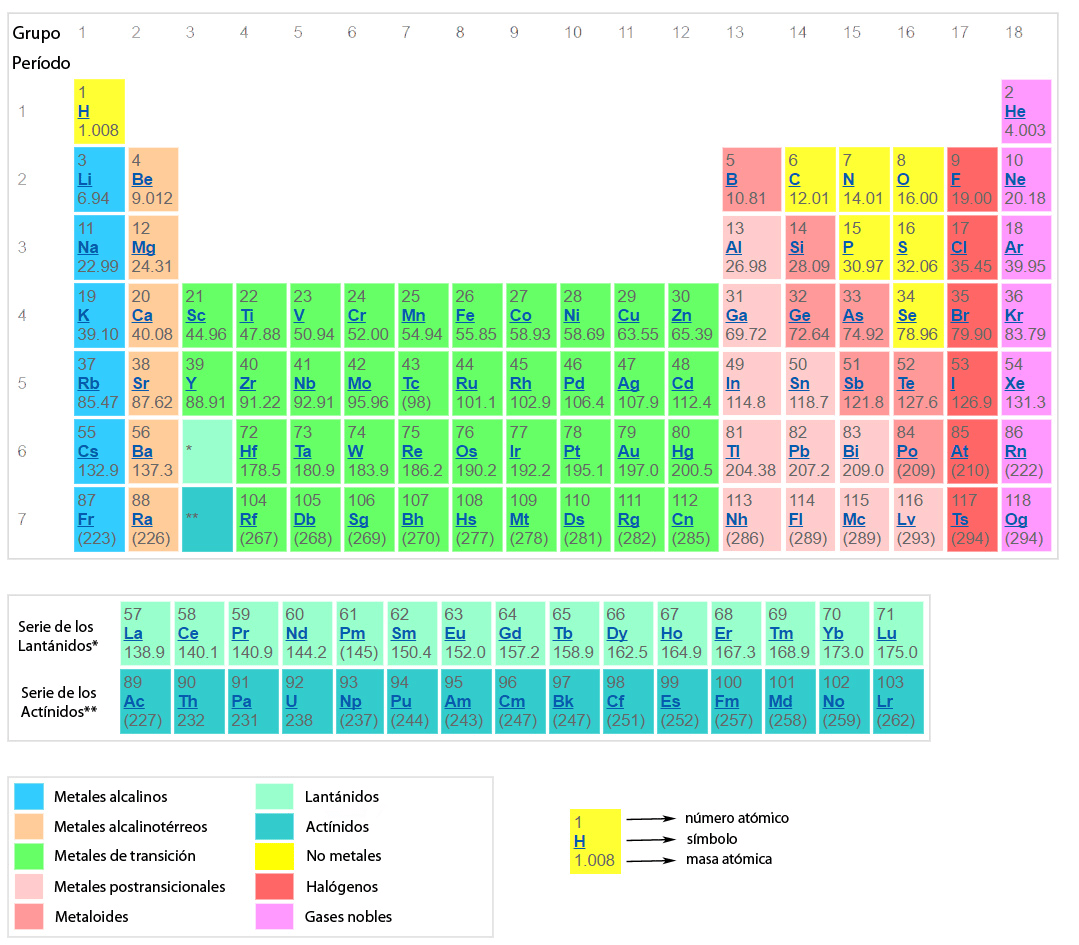
El criterio para ubicar al elemento en un periodo corresponde al número de niveles de energía de sus átomos. Así, en el primer periodo solo está el hidrógeno y el helio, que son los únicos elementos cuyos átomos tienen un solo nivel de energía ( K). En el segundo periodo estan los elementos con dos niveles de energía ( K y L ), en el tercero con tres niveles ( K, L y M) y asi hasta el septimo periodo.
La presencia del elemento en un grupo o familia está determinada por su número de electrones de valencia. Es decir aquellos electrones que están en posibilidad de formar enlaces quimicos. Existen en la tabla actual 18 grupos o familias, que la IUPAC ( International Union of Pure and Applied Chemistry ) recomienda hoy numerar del 1 al 18. Así, los elementos del grupo 1 poseen un electrón de valencia, los del grupo 2, tienen dos, y así hasta los del grupo 10 que poseen 10 electrones de valencia. Del grupo 11 al 18, los electrones de valencia son los que quedan al restar 10 al número del grupo. Los del grupo 15, por ejemplo tienen 5 electrones de valencia, los del 16 tienen 6 hasta llegar al grupo 18 cuyo elementos poseen 8 electrones de valencia, a excepción del helio que tiene 2, máximo número de electrones que caben en su primer y único nivel.
Sin embargo, debe aclararse que los elementos del grupo 18 (gases inertes o nobles), como lo indica su nombre, son muy pocos reactivos. Esto se debe a su configuración electrónica, ya que todos tienen su último nivel de energía lleno, es decir, con el máximo número de electrones posibles en dicho nivel, lo cual les confiere gran estabilidad y asi no se puede hablar con propiedad de electrones de valencia para estos elementos. Se ha propuesto situarlos en un grupo cero (y algunas tablas asi lo hacen), considerando un hipotético nivel adicional con cero electrones de valencia.
En la tabla periódica se pueden ubicar los elementos en bloques, de acuerdo con los últimos orbitales que se estan llenando. Existen en consecuencia los bloques s,p,d,f que se pueden ver en la figura.
Los elementos de las dos primeras filas corresponden al bloque s, puesto que en el subnivel s caben dos electrones, los del grupo 1 terminan su estructura electrónica en s1 y los del grupo 2 en S2.
Siguen los elementos del bloque d que comprenden los grupos 3 al 12 ( 10 grupos para 10 electrones del subnivel d) en la parte central de la tabla.
Los elementos del grupo 3 terminan su esctructura electrónica en d3, los del 4 en d4, hasta los 10 en d10. Los elementos de los grupos 11 concluyen en d1 y los del 12 en d2.
En la parte derecha se encuentran los elementos del bloque p, subnivel al cual le caben 6 electrones y por tanto aparecen 6 familias los grupos 13 al 18, cuya parte terminal varia desde p1 hasta p6 en forma progresiva, puesto que el subnivel p tiene como máximo 6 electrones.
Los 14 lantanidos y los 14 actinidos, llenan cada uno por su parte los orbitales correspondientes a los subniveles f. A todos estos se les conoce como los elementos de transicion interna y son 14 en cada uno, puesto que 14 son los electrones que caben en el subnivel f.
La distribución electrónica espectral permite en efecto situar a los elementos dentro de la tabla periódica y establecer de manera lógica varias de sus propiedades. Si se toma por ejemplo el caso del sodio ( z=11) y se dertemina su distribucion electrónica : 1s2 2s2 2p6 3s1, se puede deducir las siguientes conclusiones:
Posee tres niveles de energía, luego se halla colocado en el 3 periodo de la tabla.
Tiene un electrón en el último nivel, el tercero. Este es su electrón de valencia, lo que lo ubica en el primer grupo o familia y en el bloque s.
El hecho de contar con un solo electrón de valencia después de una estructura estable: 1s2 2s2 2p6, es decir, dos niveles llenos, el K con 2 y el L con 8 electrones, le confiere una gran estabilidad después de perder su electrón de valencia y convertirse en el ion Na+1
Na ------ 1 e ------ Na+1
Esto determina que el sodio metálico elemental sea muy inestable, pero se estabiliza si se convierte en un ion sodio. Puede deducirse tambien que el sodio no existe es estado natural sino formando parte de compuestos en los cuales se halla Na+1
De manera similar, si se conocen las tendencias predominantes a través de la tabla pueden hallarse muchas otras propiedades a partir de conceptos teóricos como son los del número cuantico y la distribución electrónica espectral.
Los diferentes grupos o familias de elementos que existen en la tabla periódica se conocen con los siguientes nombres:
Grupo 1: Alcalinos
Grupo 2: Alcalino terreos
Grupo 13: El del boro
Grupo 14: El del carbono
Grupo 15: El del nitrógeno
Grupo 16: El del oxígeno
Grupo 17: Familia de los halogenos
Grupo 18: Gases nobles.
PREGUNTA: ¿Cómo se llaman las filas horizontales de la tabla periódica?
* Columnas. * Grupos. * Filas.
* Periodos.
Descarga Tabla periódica interactiva en este link
http://www.alonsoformula.com/inorganica/tabla_periodica.htm
El enlace Químico
El enlace químico
Un enlace químico es la unión entre dos o más átomos para formar una entidad de orden superior, como una molécula o una estructura cristalina. Para formar un enlace dos reglas deben ser cumplidas regla del dueto y la regla del octeto.
¿Por qué se enlazan los atómos?
| Los átomos se enlazan para buscar el estado más estable posible. |
Entre todos los posibles estados en los que se puede encontrar un cuerpo, siempre hay uno que es más estable que los demás. todos los cuerpos tienden a alcanzar su estado más estable y, cuando lo alcanzan, tienden a permanecer en él. Así, por ejemplo, entre todas las posibles posiciones que puede tener una regla con respecto a una mesa, la posición mas estable es aquella en la que la regla descansa el máximo de su superficie sobre la mesa. Una vez que esta en esa posición, si no interviene en una fuerza externa, la regla no se movera. Igualmente entre todos los estados posibles en los que se puede encontrar un átomo, siempre hay un estado que es mas estable que los demás; los átomos tienden a alcanzar ese estado y, cuando lo alcanzan, se mantienen en el.
Si los átomos se unen para formar moléculas, esto se debe a que el estado en que se encuentran cuando están unidos es mas estable que cuando estaban separados.
¿Cómo es el estado más estable de los átomos?
Los gases nobles o elementos del grupo "O" de la tabla periódica son estables por naturaleza. Y de allí que en consecuencia no reaccionan y permanecen aislados.
Pero, ¿ a que se debe su inercia química? Ella solo es explicable con base en su estructura electrónica:
Lo único que tienen en común es el hecho de poseer 8 electrones en su último nivel de energía. Como los gases nobles no tienden a enlazarse, se deduce que el octeto debe ser una disposición muy estable.
Sobre la base de esta observación, Walther Kossel y Gilbert Lewis concluyeron en 1916, que la tendencia a lograr estructuras similares a los gases nobles explica los enlaces químicos en todos los compuestos. Su conclusión quedo expresada en la regla del octeto, la cual afirma que:
“ Cuando se forma un enlace químico, los átomos reciben, ceden o comparten electrones de tal forma, que la capa mas externa de cada átomo contenga ocho electrones , y así adquiera la estructura electrónica del gases nobles mas cercano en el sistema periódico “
Aunque esta regla no es general, es muy útil para explicar los enlaces de los elementos de los primeros periodos.
¿Cómo funciona la regla octeto?
Algunos átomos ceden electrones para cumplir la regla del octeto. |
El sodio ilustra este caso.
1s2 - 2s2 -2p6 - 3s1 ...... 1s2 -2s2- 2p6 + 1e-
Atomo de sodio Ión sodio
Na° Na+
El átomo de sodio cede un electrón y se transforma en un ión sodio. Este último presenta la misma estructura electrónica del neón.
Otros elementos ganan electrones para ubicar en su último nivel ocho electrones. |
El cloro es un ejemplo:
1s2- 2s2 -2p6 -3s2 -3p5 + 1e-......
Atomo de cloro CL°.........1s2- 2s2 -2p6 -3s2-3p6 Ión cloro Cl-
El cloro gana un electrón y consigue estabilidad adquiriendo la estructura del argón. También podría suceder que pierda siete electrones para tomar la estructura del neón.
Sin embargo, esta última situación es poco probable puesto que el potencial de ionización aumenta rápidamente con la perdida adicional de cada electrón, haciendo muy difícil la remoción de siete electrones.
La capa de valencia.
Se llama capa de valencia la capa más externa de cualquier átomo, y se llaman electrones de valencia a los electrones situados en ella.
La fuerza con la cual un electrón es atraído por el núcleo depende de la capa o nivel en la que dicho electrón esta localizado: los más cercanos son atraídos con más fuerza, en tanto que los exteriores están sometidos a una atracción mucho menor. Lo anterior hace que los electrones de valencia se encuentren casi libres. Esto les permitirá participar directamente en la formación de los enlaces y en consecuencia determinar el comportamiento químico de los elementos.
El comportamiento de un átomo depende fundamentalmente del número de electrones presentes en su capa de valencia. |
O dicho en otras palabras: cuando dos o más elementos químicos tienen el mismo número de electrones en su capa de valencia, sus maneras de reaccionar o enlazarse son muy parecidas.
Pregunta. ¿Qué indica la regla del octecto?
* Transformarse en otro elemento.
* Que los elemento así ganen o pierdan electrones, tengan ocho
electrones en su capa de valencia.
* Ganar o perder electrones.
Estructuras de Lewis
Estructura de Lewis, también llamadas diagramas de puntos, son representaciones gráficas que muestran los enlaces entre los átomos de una molécula y los pares de electrones solitarios que puedan existir. Un punto para cada electron - alrededor del simbolo del elemento así:
La estructura de Lewis permite ilustrar de manera sencilla los enlaces químicos, en ella, el símbolo del elemento está rodeado de puntos o pequeñas cruces que corresponden al número de electrones presentes en la capa de valencia.
El diagrama de Lewis se puede usar tanto para representar moléculas formadas por la unión de sus átomos mediante enlace covalente como complejos de coordinación. La estructura de Lewis fue propuesta por Gilbert Lewis, quien lo introdujo por primera vez en 1916 en su artículo La molécula y el átomo.
Las estructuras de Lewis muestran los diferentes átomos de una determinada molécula usando su símbolo químico y líneas que se trazan entre los átomos que se unen entre sí. En ocasiones, para representar cada enlace, se usan pares de puntos en vez de líneas. Los electrones desapareados (los que no participan en los enlaces) se representan mediante una línea o con un par de puntos, y se colocan alrededor de los átomos a los que pertenece.
MECANISMOS DE ENLACE:
Los mecanismos utilizados por los átomos para formar enlaces son:
a) transferencia de electrones: El enlace utilizado para la formación del compuesto AB ocurre por transferencia de electrones.
El átomo A transfiere su electrón de valencia al átomo B, para que este complete 8 electrones en su capa externa.
B) Compartición de electrones.
El compuesto Cd se forma por un enlace en donde se comparten electrones.
Los átomos C y D comparten un electrón para que cada uno complete 8 en su capa externa.
Pregunta: La estrctura de lewis representa:
* El átomo. * Los
electrones de un átomo. * La
molécula
Clases de enlaces
Definición de enlace químico.
Se define como la fuerza de unión que existe entre dos átomos, cualquiera que sea su naturaleza, debido a la transferencia total o parcial de electrones para adquirir ambos la configuración electrónica estable correspondiente a los gases inerte; es decir, el enlace es el proceso por el cual se unen átomos iguales o diferentes para adquirir la configuración electrónica estable de los gases inertes y formar moléculas estables.
Enlace iónico: Se obtiene por la transferencia de electrones de un átomo a otro convirtiendose los átomos neutros en iones cargados eléctricamente. Estos iones de cargas eléctricas se atraen mutuamente.
Ejemplo:
La formación del enlace iónico entre los átomos de potasio y fluor se explica así:
El átomo de potasio al tener un bajo potencial de ionización, libera fácilmente su electrón de valencia, que es atraído por el átomo de flúor que posee un alto valor de afinidad electrónica; simultaneamente, los átomos de potasio y flúor adquieren estructuras iónicas como consecuencia del intercambio de electrones.
Características del enlace iónico.
- Se rompe con facilidad obteniéndose los iones que lo forman, generalmente basta disolver la sustancia.
- Las sustancias con enlaces iónicos son solubles en solventes polares.
Enlace Covalente:
Este enlace se obtiene por compartimiento de electrones entre dos o mas atomos, cuya diferencia de electronegatividad no sea muy grande o igual.
Esta unión se representa por un guión o línea entre átomos que forman el enlace.
Según el concepto de electronegatividad, se considera esta propiedad de gran utilidad para analizar e interpretar los mecanismo de los enlaces.
En la siguiente tabla se pueden observar las diferentes electronegatividades de algunos átomos:
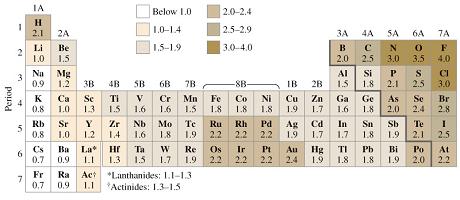
Si la diferencia de electronegatividad es menor de 1.7 o igual a cero se dice que el enlace es covalente.
Ejemplo:
Características del enlace covalente.
- Es muy fuerte y se rompe con dificultad.
- Si la diferencia de electronegatividades entre los 2 átomos es marcada, tenemos un enlace polar y se favorecerá la solubilidad de la sustancia en solventes polares. Ejemplo: un enlace O-H
- Si la diferencia de electronegatividades es poca, tenemos un enlace no polar y se favorecerá la solubilidad de la sustancia en solventes no polares. Ejemplo: un enlace C-H o C-C
Clases de enlace covalente.
El enlace covalente se puede clasificar teniendo en cuenta los siguientes factores:
A.Numero de electrones compartidos
1. Si se comparten dos electrones el enlace es covalente sencillo
En la formación de la molécula de agua, el oxígeno (O) con seis electrones de valencia se combina con los electrones de valencia de dos átomos de hidrógeno para adquirir la configuración del gas noble neón; el hidrógeno (H) a su vez toma un electrón del oxígeno para adquirir la configuración del gas helio.
2. Si se comparten cuatro electrones el enlace es covalente doble. El eteno y la molécula de oxígeno O2 son compuesto con un enlace doble.
3. Si se comparten seis electrones el enlace es covalente triple:
B. Diferencia de electronegatividad
1. cuando los átomos que comparten electrones son iguales y la diferencia de electronegatividad es cero, el enlace es covalente no polar.
Enlaces covalentes no polares:
Los enlaces covalentes pueden ser polares y no polares. En un enlace no polar tal como el de la molécula de hidrógeno, H2, el par electrónico es igualmente compartido entre los dos núcleos de hidrógeno. Ambos átomos de hidrógeno tienen la misma electronegatividad (tendencia de un átomo a atraer los electrones hacia sí en un enlace químico), es decir, que los electrones compartidos están igualmente atraídos por ambos núcleos de hidrógeno y por tanto pasan iguales tiempos cerca de cada núcleo. En este enlace covalente no polar, la densidad electrónica es simétrica con respecto a un plano perpendicular a la línea entre los dos núcleos. Esto es cierto para todas las moléculas diatómicas homonucleares, tales como H2, O2, N2, F2 y Cl2, porque los dos átomos idénticos tienen electronegatividades idénticas. Por lo que podemos decir, los enlaces covalentes en todas las moléculas diatómicas homonucleares deben ser no polares.
Enlace covalente polar
Tal como el fluoruro de hidrógeno los pares electrónicos están compartidos desigualmente. El enlace H-F tiene algún grado de polaridad ya que H y F no son átomos idénticos y por lo tanto no atraen igualmente a los electrones. La electronegatividad del hidrógeno es 2,1 y la del fluor es de 4,0, claramente el átomo F con su mayor electronegatividad, atrae el par electrónico compartido mucho más fuertemente que H. La distribución asimétrica de la densidad electrónica está distorsionada en la dirección del átomo más electronegativo F. Este pequeño desplazamiento de densidad electrónica deja a H algo positivo. El HF se considera una molécula diatómica heteronuclear, ya que contiene dos clases de átomo.
Pregunta: En la mayor parte de las moléculas los átomos están enlazados por:
* En la mayor parte de las moléculas los átomos están enlazados por
uniones covalentes.
* En la mayor parte de las moléculas los átomos están enlazados por
átomos.
* En la mayor parte de las moléculas los átomos están enlazados por
moléculas.
Fórmula Química
Formulación química es la disciplina que regula las convenciones a emplear en la utilización de fórmulas químicas. Una fórmula química se compone de símbolos y subíndices, correspondiéndose los símbolos con los de los elementos que formen el compuesto químico a formular y los subíndices con las necesidades de átomos de dichos elementos para alcanzar la estabilidad molecular. Así, sabemos que una molécula descrita por la fórmula H2SO4 posee dos átomos de Hidrógeno, un átomo de Azufre y 4 átomos de Oxígeno.
Clases de fórmula
Las fórmula se pueden clasificar en dos grupos:
1. En el primero tenemos las fórmulas obtenidas por análisis químico que son la fórmula mínima y la molecular.
2. En el segundo encontramos las fórmulas que se obtienen directamente a partir de la fórmula molecular, son la fórmula esctructural y electrónica.
Empíricas o Mínimas:
Nos indica la proporción más sencilla y se determina mediante análisis químicos. Informa sobre el tipo de átomos que forman la molécula, y la relación mínima en el cual estos se combinan.
Ejemplo: Fórmula empírica del Ácido Sulfúrico H2SO4. Esta expresa que el el hidrógeno, el azufre y el oxígeno se combinan en proporción 2:1:4.
Fórmulas Moleculares:
Nos da el número real o verdadero de átomos de cada elemento. Indica el número mol de átomos de cada especie que constituye la molécula. En algunos compuesto la fórmula mínima y molecular son identicas, por ejemplo, en el H2SO4, en otros compuesto la fórmula mínima y molecular son diferentes. La fórmula molecular de la glucosa es C6H12O6.
Para los compuestos iónicos como el NaCl, Naf, no existe fórmula molecular, puesto que no hay moléculas sino iones.
NaF ------ Na+ F -
Fórmula Estructural:
Es la fórmula más completa, nos muestra como se distribuyen y enlazan los átomos en la molécula.
Ejemplo
Fórmula Molecular | Fórmula estructural |
H2 | H-H |
Fórmula Electrónica:
Nos muestra la distribución, enlaces de los átomos y los electrones que lo contienen de todos y cada uno de los átomos de la molécula.
| Fórmula molecular | Fórmula estructural | Fórmula electrónica |
| H2 | H-H | H··H |
Pregunta: ¿cuál es la fórmula que determina los átomos que componen a la sustancia y la relación mínima entre ellos?
* Fórmula Electrónica.
* Fórmula empírica o fórmula mínima.
* Fórmula estructural.
* Fórmula molecular.
Segunda parte de Fórmula Química
Todos los compuestos que participan en las reacciones y procesos químicos estan representados mediantes fórmulas. Estas se determinan experimentalmente empleando el análisis químico, del cual se obtiene la composición porcentual de la sustancia.
Porcentaje en Peso
El primer paso para resolver la fórmula química de una sustancia, es determinar los gramos de cada elemento contenidos en 100 gr del compuesto. De esta manera se hallan los porcentajes en peso o composición porcentual .
Si un compuesto tiene dos elementos X e Y, la composición porcentual de este se halla utilizando la siguiente relación:
Calculamos el número de unidades de masa atómica del primer elemento de la fórmula (masa atómica multiplicada por el número de átomos que hay de dicho elemento en la fórmula). Dicho número lo dividimos por la masa molecular (masa de todo el compuesto en unidades de masa atómica) y el resultado se multiplica por cien.
Problemas Resueltos
a. Determinar los porcentajes en pesos de un óxido de cobre si 20 gr de este contiene 16 gr de cobre.
Solución
Para hallar el oxígeno contenido en el compuesto, se hace una diferencia entre el peso del óxido menos el peso del cobre.
20 gr - 16 gr = 4 gr de oxígeno
b. Calcular los porcentajes en peso del dióxido del carbono (CO2) si los pesos atomicos de los elementos del compuestos son:
C=12.
O= 16 * 2 = 32.
El peso molecular del compuesto es igual a 12+32= 44.
%C =(12 ÷ 44) × 100 = 27,3% de C
%O =(32 ÷ 44) × 100 = 72,7% de O
Para comprobar %C+%O = 100 %
27,3 %+72,7% = 100%
Fórmula mínima o empírica
La fórmula mínima se puede establecer a partir de los datos sumunistrados por los porcentajes en pesos o por el número de gramos de los elementos del compuesto.
En cada caso, es necesario determinar la relación del número de moles de átomos de cada elemento del compuesto. Los números que expresan esta relación, aparecen como subíndices.
Problemas resueltos
a. El análisis de un compuesto dio el siguiente resultado en composicion porcentual: Hidrógeno 2.06 %, azufre 32.69 % y oxígeno 65.25 %. Determinar la fórmula mínima.
Solución
Se convierte la composición porcentual a gramos. Como la composición porcentual indica el número de gramos de cada elemento por 100 gr del compuesto, entonces en 100 gramos del compuesto analizado tenemos:
2.06 gramos de hidrógeno; 32.69 gramos de azufe y 65.25 gramos de oxígeno.
Se transforma los gramos de cada elemento en moles de átomos.
Para determinar el número relativo de moles dividimos cada uno de estos valores por el más pequeño de ellos, para este caso sería 1.02.
Al realizar las divisiones nos queda: H = 2; S = 1; O = 4.
Estos números son subíndices en la fórmula del compuesto. Por consiguiente la fórmula mínima o empírica es H2SO4.
Fórmula molecular
La fórmula molecular de un compuesto se halla a partir de la masa molecular en gramos del compuesto, y la fórmula mínima de este. La fórmula molecular es un multiplo m (m = 1,2,3,...) de la fórmula mínima. En donde el valor de m es:
Problemas resuelto
a. ¿Cuál es la fórmula molecular de un compuesto si su fórmula mímina es AlCl3 y su peso molecular es 267 u?
La masa de la fórmula mínima es:
Peso de cada uno
Al = 26.98
Cl = 35.45 × 3
26.98 u + 3 ( 35.45 u) = 133.3
El multiplo m igual a:
m = 2
Recuerda que el m debe ser un entero. Si no lo es, se revisan los calculos nuevamente.
La fórmula molecular = 2( AlCl3 ) = Al2 Cl6.
PREGUNTA: ¿Cuál es la fórmula mínima de un compuesto que contiene 75.74 gr de As y 31.98 gramos de oxígeno? * As2O3 * AsO2 * As3O2
Nomenclatura Química
La nomenclatura química se encarga de asignar un nombre a cada compuesto. Para lo cual se siguen las siguientes reglas o acuerdos.
A partir de dicho nombre, se puede establecer la fórmula del compuesto , y por consiguiente , su composición. La nomenclatura también permite llegar al nombre del compuesto a partir de la formula.
Para escribir la formula correcta de los compuesto , es necesario saber los símbolos de los distintos elementos, su posición en al tabla periódica y algunas propiedades como la capacidad de combinación de los átomos y sus números de oxidación.
Capacidad de combinación o valencia
La capacidad de combinación de un átomo recibe el nombre de valencia . Se representa con un numero que indica la cantidad de enlaces formados.
En la molécula de H2O , el oxigeno tiene valencia 2, como consecuencia de sus dos enlaces con los hidrógenos . A su vez, cada hidrogeno tiene valencia 1.
La valencia y su representación
El termino valencia identifica la cantidad de enlaces formados por un átomo.
La valencia de oxigeno es 2, por que dicho elemento está en capacidad de formar dos enlaces. La valencia del hidrogeno es 1 por que siempre forma un solo enlace con el único electrón que posee. Obsérvese como se representa con líneas las valencias de los elementos que forman la molécula de acido sulfhídrico (H2S).
Números o estados de oxidación
Estado de oxidación es al carga eléctrica que un átomo parece tener cuando forma parte de un compuesto.
La carga eléctrica depende de la cantidad de electrones ganados, perdidos o compartidos por un átomo.
si un átomo, gana electrones, se reduce y queda con carga negativa o número de oxidación negativo. Su valor depende del número de electrones que el átomo haya ganado.
Cl + 1 e - _____ Cl -
El cloro queda con número de oxidación -1, porque ha ganado un electrón. Es un ion negativo o anión.
Si un átomo pierde electrones, se oxida y queda con carga positiva o número de oxidación positivo. Su valor depende del número de electrones que el haya perdido.
Na -1 e - _____ Na +
El sodio queda con número de oxidación +1, porque perdió +1 electrón. Es un ion positivo o catión.
Reglas para determinar el estado de oxidación
En las sustancias simples, es decir las formadas por un solo elemento, el número de oxidación es 0. Por ejemplo: Auo, Cl2o, S8o.
El oxígeno, cuando está combinado, actúa frecuentemente con -2, a excepción de los peróxidos, en cuyo caso actúa con número de oxidación -1.
El Hidrógeno actúa con número de oxidación +1 cuando está combinado con un no metal, por ser éstos más electronegativos; y con -1 cuando está combinado con un metal, por ser éstos más electropositivos.
En los iones monoatómicos, el número de oxidación coincide con la carga del ión.
Por ejemplo:
Na+1 (Carga del ión) +1 (Número de oxidación)
S-2 -2 (Número de oxidación)
Al+ +3 (Número de oxidación)
Recordemos que los elementos de los grupos IA (1) y IIA (2) forman iones de carga +1 y +2 respectivamente, y los del VIIA (17) y VIA(16), de carga –1 y –2 cuando son monoatómicos.
La suma de los números de oxidación es igual a la carga de la especie; es decir, que si se trata de sustancias, la suma será 0, mientras que si se trata de iones, será igual a la carga de éstos.
Por ejemplo:
a) Para calcular el número de oxidación del S en el Na2SO3, no podemos recurrir a la tabla periódica, ya que da varios números para este elemento. Nos basaremos en los elementos que no tienen opción, que son el Na: +1 y el O: -2.
+1 X -2
Na2SO3
Nota: es frecuente colocar los números de oxidación individuales en la parte superior de cada elemento.
La suma de los números de oxidación en este caso debe ser igual a 0, ya que la especie en cuestión no posee carga residual:
(+1) x 2 + X + (-2) x 3 = 0
2 + X - 6 = 0
X = + 4
+1 +4 -2
Na2S4O3
Los iones y los compuestos
Un gran número de compuestos químicos se forma por la unión de iones de carga contraria.
Cuando dos iones forman un compuesto, las cargas positivas totales deben ser iguales a las cargas negativas totales. De esta manera, la suma algebraica de las cargas en el compuesto es cero.
Na + + Cl -
La única carga positiva del ion sodio se compensa con la única carga negativa del ion cloro.
En toda formula química, siempre se escribe la parte positiva primero y luego la negativa.
Pregunta: Teniendo en cuenta las reglas para determinar los estados de oxidación, calcule el estado de oxidación del N en el compuesto HNO2: a) +3 b) -3 c) 2
Comportamiento de los metales y de los no metales
Los metales tienen un número de oxidación positivo, porque pierden fácilmente electrones. Los no metales tienen tendencia a números de oxidación negativos porque los ganan con facilidad.
Cuando los elementos del grupo 1 de la tabla periódica forman compuestos, tienen estado de oxidación + 1, por que usualmente pierden un electrón.
Los del grupo 2 tienen número de oxidación +2, por que tienen una tendencia a perder 2 electrones. En general, un número de oxidación positivo para cualquier elemento es igual al número del grupo del elemento en la tabla.
El número de oxidación negativo para cualquier elemento se puede obtener substrayendo de 8 el número del grupo y dándole a la diferencia un signo negativo. Por esto el flúor es -1 y el azufre tiene un número de oxidación -2. Significa que el flúor tiene tendencia a ganar un electrón y el azufre a ganar dos electrones.
RELACIÓN ENTRE LA VALENCIA Y EL NÚMERO DE OXIDACIÓN:
En la mayoría de los casos, el valor numérico del estado de oxidación coincide con el valor de la valencia.
El calcio tiene número de oxidación +2 y su valencia es 2.
Tal hecho se da porque su carga la adquirió al ceder dos electrones. Y como cada electrón forma un enlace al aparearse con otro, se originan también dos enlaces.
La valencia de un elemento no tiene signo; el estado de oxidación sí.
PROPORCIÓN DE COMBINACIÓN ENTRE LOS ELEMENTOS
Cuando los átomos se combinan para formar compuestos, deben utilizar la totalidad de su capacidad de enlace o valencia.
Por ejemplo, la unión entre oxígeno y el hidrógeno se realiza con un átomo del primero y dos del segundo, debido a que sus valencias son dos y uno, respectivamente.
CLASES DE COMPUESTOS:
Los compuestos químicos se dividen en tres categorías:
Binarios, terciarios y complejos.
a) Compuestos binarios o de dos elementos:
Na2 O Hbr.
b) Compuestos terciarios o de tres elementos
KCIO3 H2SO4
c) Compuestos complejos: de cuatro o más elementos:
CuOHNO3.
LOS ELEMENTOS Y SU VALENCIA
Todos los elementos presentan más de una valencia.
Por ejemplo, el hierro puede perder dos o tres electrones de allí que en ciertos compuestos tenga numero de oxidación + 2 y en otros + 3. sus valencias serán 2 y 3.
Cómo establecer la valencia de un elemento:
para establecer la valencia de un elemento hay que determinar su ubicación en la tabla periódica.
A partir de ella se establece que :
La valencia más probable para los elementos de los grupos 1,2,3 y 4 esta dada por el numero del grupo. El sodio tiene valencia 1 porque pertenece al grupo 1.
La valencia más probable para los elementos de los grupos 5,6,y7 se encuentra restándole a 8 el número del grupo. La valencia más probable del oxigeno es 2 valor que se obtiene al restar de 8 el número 6, que corresponde al grupo del oxigeno.
Desde el grupo 4 en adelante, los elementos además de su valencia más probable tienen otras. Los elementos de los grupos pares tienen valencias pares de anteriores y los impares, las valencias impares anteriores. Por ejemplo, el cloro pertenece al grupo 7; como es impar sus valencias será 1,3,5 y 7.
El azufre pertenece al grupo 6, superior al 4 y par sus valencias serán 2,4 y 6.
Pregunta: ¿Los metales tienen un número de oxidación positivo, porque?
Porque ganan fácilmente electrones.
Pierden fácilmente iones y carga positiva.
Porque pierden fácilmente electrones.
¿Qué es una función química?
FUNCIÓN QUÍMICA
Una función química está constituida por un grupo de compuestos que poseen propiedades parecidas.
Por ejemplo, existe un grupo de compuestos que forman la función óxido. Todos ellos están constituidos por dos elementos. Uno de los cuales es el oxígeno. Son óxidos: CaO (óxido de calcio); MgO (óxido de magnesio); Al2O3 (óxido de aluminio).
Función hidruro
La combinación del Hidrógeno con un metal, forma los hidruros. En este caso el Hidrógeno presenta un estado de oxidación de -1:
![]()
Para nombrarlos se utiliza la palabra hidruro, la preposición de y el nombre del elemento metálico.
Función ácido hidrácido
Los ácidos hidrácidos están formados por la combinación del Hidrógeno con un no metal de los grupos VI y VII

Función óxido
Los óxidos son la combinaciones de un elemento con el oxígeno. Existen dos grupos: los óxidos básicos y los óxidos ácidos.
Oxido básico: Resulta de la unión del oxígeno con un metal.

Oxido ácido o anhídrido: Resulta de la unión del oxigeno con un no metal.
![]()
Función hidróxido
Un óxido básico al reaccionar con el agua forma las bases o hidróxidos. Estos son compuestos que tienen uno o mas iones hidroxilo u oxidrilo (OH-)

Función ácido oxácido
Un óxido ácido o anhídrido al reaccionar con el agua forma los ácidos oxácidos.

Función sal
La reacción entre un hidróxido y un ácido da como resultado una sal más agua.

Sales haloideas
Resulta de la reacción de un base y un ácido hidrácido.

Oxisales o sales oxácidos
La reacción de una base y un oxácidos produce una sal oxácido más agua.
![]()
Sales ácidas
Resulta de la sustitución parcial de los hidrógenos del ácido por un metal.
![]()
Sales básicas
Resulta de la sustitución parcial de los hidróxidos ( OH-) de las bases por no metales.
![]()
Sale neutras
Se obtiene por la sustitución total de los hidrógenos del ácido.
![]()
Sales dobles
Se obtiene sustituyendo los hidrógenos del ácido por más de un metal.
![]()
Pregunta. Un hidrácido se forma a partir de:
Del hidrogeno con el oxigeno
de un elemento con el oxigeno
No metal + hidrogeno
Nomenclatura química de los compuestos inorgánicos
Nomenclatura química de los compuestos inorgánicos
Para iniciar el estudio de la nomenclatura es necesario distinguir primero entre compuestos orgánicos e inorgánicos. Los compuestos orgánicos contienen carbono, comúnmente en combinación con elementos como hidrógeno, oxígeno, nitrógeno y azufre. El resto de los compuestos se clasifican como compuestos inorgánicos. Éstos se nombran según las reglas establecidas por la IUPAC.
Nomenclaturas
Se aceptan 3 tipos de nomenclaturas para nombrar compuestos químicos inorgánicos:
Nomenclatura sistemática: para nombrar de este modo se usan prefijos numéricos excepto para indicar que el primer elemento de la fórmula sólo aparece una vez (mono) o cuando no puede haber confusión posible debido a que tenga una única valencia.
Prefijos griegos | Número |
mono- | 1 |
di- | 2 |
tri- | 3 |
tetra- | 4 |
penta- | 5 |
hexa- | 6 |
hepta- | 7 |
octa- | 8 |
nona- (o eneá) | 9 |
deca- | 10 |
Ejemplos: CrBr3 tribromuro de cromo; CO monóxido de carbono.
En los casos en los que puede haber confusión con otros compuestos (sales dobles y triples, oxisales y similares) se pueden emplear los prefijos bis, tris, tetraquis, pentaquis...
Ejemplo: Ca5F(PO4)3 fluoruro tris(fosfato) de calcio porque si se dijese trifosfato se estaría hablando del anión trifosfato [P3O10]5, es decir, sería en este caso:
Ca8F(P3O10)3
Nomenclatura stock o IUPAC: En este caso, cuando el elemento que forma el compuesto tiene más de una valencia atómica, se indica en números romanos al final y entre paréntesis. Normalmente, a menos que se haya simplificado la fórmula, la valencia puede verse en el subíndice del otro átomo (compuestos binarios).
Ejemplo: Fe2S3 Sulfuro de hierro (III) [se ve la valencia III en el subíndice del azufre]
Nomenclatura tradicional: Aquí se indica la valencia del elemento que forma el compuesto con una serie de prefijos y sufijos.
Cuando el elemento sólo tiene una valencia, simplemente se coloca el nombre del elemento precedido de la sílaba “de” y en algunos casos se puede optar por usar el sufijo –ico.
Cuando tiene dos valencias diferentes se usan (de menor a mayor valencia)
-oso
-ico
Cuando tiene tres distintas se usan (de menor a mayor)
hipo- -oso
-oso
-ico
Y cuando tiene cuatro se utilizan (de menor a mayor)
hipo- -oso
-oso
-ico
per- -ico
Ejemplo: Mn2O7 Óxido permangánico
Pregunta. Cuando se emplean prefijos y sufijos para escribir la nomenclatura de los compuesto, es en:
Los óxidos básicos y su nomenclatura
¿Cómo se nombran un óxido básico?
Lo primero que se debe hacer es identificar los números de oxidación posibles para el metal (Tabla periódica). Si se presenta un solo estado de oxidación, ejemplo: Li+1 Be+2 Na+1, la forma de nombrar sus óxidos es: Li2O, Oxido de litio. Si se presentan dos números de oxidación se usan las terminaciones, OSO: para el número de oxidación menor, ICO: para el número de oxidación mayor. El Cu tiene número de oxidación de +1 y +2 . Sus óxidos son: Cu2O, óxido cuproso; CuO, óxido cúprico. En el sistema moderno de nomenclatura recomendado por la IUPAC, el número de oxidación del metal que se combina con el oxígeno, se indica con números romanos entre paréntesis al final del nombre del elemento: Cu2O, óxido de cobre (I) y CuO, óxido de cobre (II).
¿Cómo se construye la fórmula de un óxido?
Para elaborar la fórmula de un óxido, a partir del nombre, por ejemplo óxido de calcio, primero se escribe el metal o el no metal y luego el oxígeno: CaO. Luego se colocan intercambiadas las valencias y se simplifica si es el caso: Ca2O2, simplificado, CaO.
Los óxidos ácidos y su nomenclatura
Los óxidos ácidos siguen las misma reglas de nomenclatura que los óxidos básicos aunque se pueden nombrar como anhídridos en vez de óxidos. En ocasiones se colocan los prefijos mono, di o tri para hacer énfasis en la cantidad de átomos.
Ejemplo | Nomenclatura sistemática | Nomenclatura IUPAC | Nomenclatura tradicional |
K2O | monóxido de dipotasio | óxido de potasio | óxido potásico |
Fe2O3 | trióxido de dihierro | óxido de hierro(III) | óxido férrico |
FeO | monóxido de hierro | óxido hierro(II) | óxido ferroso |
SnO2 | dióxido de estaño | óxido de estaño (IV) | óxido estánnico |
NOMENCLATURA DE ÓXIDOS BÁSICOS/ÓXIDOS ÁCIDOS
Para nombrarlos se antepone la palabra ÓXIDO al nombre del elemento.
Ejemplo:
Al2O3 óxido de aluminio
Na2O óxido de sodio
En los ejemplos citados (óxido de aluminio y óxido de sodio), los elementos que acompañan en cada caso al oxígeno poseen un solo estado de oxidación. El estado de oxidación del Al es 3 y el Na es 1.
Por dicha razón cuando se habla del óxido de aluminio no hay duda sobre que óxido se nombra.
Pero si el elemento que forma el óxido tuviera dos o más estados de oxidación la nomenclatura debería permitir dejar en claro con que estado de oxidación está actuando dicho elemento, al formar cada óxido.
¿cómo se nombran los óxidos cuando el elemento que acompaña al oxígeno posee 2 estados de oxidación?
Para nombrarlos se antepone la palabra óxido seguido por: Raiz del Nombre del Elemento + Terminación OSO o ICO
Debe advertirse que algunas de estas raíces tienen un cambio bastante significativo con respecto al nombre que leemos en la Tabla Periódica. Para comprender dicho cambio se agrega la siguiente tabla:
|
|
|
Azufre | Sulphur | Sulfur |
Cobre | Cuprum | Cupr |
Estaño | Stannum | Estann |
Hierro | Ferrum | Ferr |
Oro | Aurum | Aur |
Plomo | Plumbum | Plumb |
Ejemplos: FeO, óxido ferroso; CuO, óxido cúprico; SO2, óxido sulfuroso.
Terminación OSO: indica que el elemento está usando el menor estado de oxidación.
Terminación ICO: indica que el elemento está usando el mayor estado de oxidación.
¿Cómo se nombran los óxidos cuando el elemento que acompaña al oxígeno posee 4 estados de oxidación? Concretamente el caso del Cl, Br...
Terminación OSO: cuando el elemento usa alguno de los dos menores estados de oxidación. Prefijo HIPO: cuando utiliza el menor de sus estados de oxidación.
Terminación ICO: cuando el elemento usa alguno de los dos mayores estados de oxidación.
Prefijo PER: cuando utiliza el mayor de sus estados de oxidación. Ejemplo, con el CLORO:
fórmula | Estado de oxidación del CLORO | Nombre del óxido |
Cl2O | 1 | óxido hipocloroso |
Cl2O3 | 3 | óxido cloroso |
Cl2O5 | 5 | óxido clórico |
Cl2O7 | 7 | óxido perclórico |
PREGUNTA: ¿Cómo se nombra el siguiente compuesto? FeO
HIDRÓXIDOS
La unión del metal con grupos OH, forma las bases o hidróxidos: KOH.
COMO SE NOMBRAN UN HIDRÓXIDO
Tradicionalmente se nombran con la palabra hidróxido seguida del nombre del metal. Este llevara la terminación que aclare su número de oxidación.
Para formularlo se coloca al metal y el grupo hidroxilo OH, que siempre tiene valencia (-1). La fórmula general es M(OH)x siendo x la valencia del metal.
La nomenclatura IUPAC es la más frecuente. Aquí la nomenclatura sistemática no antepone el prefijo mono cuando sólo hay un OH. Este llevara la terminación que aclare su número de oxidación.
Nomenclatura tradicional | Nomenclatura IUPAC |
NaOH Hidroxido de sodio | Hidróxido de sodio |
Fe(OH)2 Hidróxido ferroso | Hidróxido de hierro (II) |
Fe(OH)3 Hidróxido ferrico | Hidróxido de Hierro (III) |
CuOH Hidroxido cuproso | Hidróxido de cobre (I) |
Cu(OH)2 Hidróxido cuprico | Hidróxido de cobre (II) |
Pregunta. El grupo característico de los hidróxilos es:
Los ácidos y su nomenclatura
a) Hidrácidos: Son compuestos binarios formados por la combianción del hidrógeno (H) con un no metal, principalmente de los grupos VI y VII.
Cómo se nombran los hidrácidos?
Se nombran con la palabra ácido, seguida del nombre del elemento no metálico con la terminación hídrico.
HCL: ácido clorhídrico
HI: ácido yodhídrico
H2S: ácido sulfuhídrico
b) Oxácidos: Son compuestos ternarios formados por la combinación de un óxido ácido con agua:
CO2 + H2O -----> H2CO3 (ácido carbónico)
Cómo se nombran los ácidos del grupo V?
Los elementos de este grupo actuan con valencias 1, 3 y 5. Estos tres grados de valencia se identifican así:
HNO ácido hiponitroso
HNO2 ácido nitroso
HNO3 ácido nítrico
Cómo se nombran los ácidos del grupo VI?
Los elementos de este grupo actuan con valencias 2, 4 y 6. Por consiguiente, sus ácidos siguen la misma reglas de nomenclatura que los del grupo V:
H2SeO2 ácido hiposelenioso
H2SeO3 ácido selenioso
H2SeO4 ácido selénico
Cómo se nombran los acidos del grupo VII?
Los elementos de este grupo presentan cuatro valencias impares: 1, 3, 5, 7.Para diferenciar los cuatros ácidos que forman, se usan los siguientes prefijos y sufijos:
Así quedan los ácidos del yodo:
HIO ácido hipoyodoso
HIO2 ácido yodoso
HIO3 ácido yódico
HIO4 ácido peryódico
Pregunta. Pertenece a los ácidos oxácidos:
Reacciones Químicas
Una reacción química es el proceso por el cual unas sustancias se transforman en otras. Por ejemplo, el H2 y el Cl2 reaccionan para originar un nuevo compuesto, el HCl. Las sustancias iniciales se llaman reactivos y las que resultan de su transformación son los productos.
ECUACIÓN QUÍMICA
LA ECUACIÓN QUÍMICA ES LA REPRESENTACIÓN EN FORMA CORTA Y PRECISA DE UN CAMBIO O REACCIÓN QUÍMICA.
En la ecuación química, los reactivos se escriben a la izquierda y los productos a la derecha, separados por una flecha:
KOH + HBr → KBr + H20
reactivos productos
Características de una ecuación
1. La ecuación química debe indicar el estado físico de los reactivos y de los productos. Para ello se usan los siguientes símbolos:
(g) para representar el estado gaseoso.
(I) para representar el estado líquido.
(s) para representar el estado sólido.
(ac) para representar disolución acuosa.
Usualmente estos símbolos se omiten y sólo se usan cuando es estrictamente necesario.
2. En la ecuación deben indicarse los catalizadores, que son sustancias que aceleran o disminuyen la velocidad de una reacción. Los catalizadores no son consumidos en las reacciones y se colocan encima o debajo de la flecha que separa los reactivos de los productos.
3. En toda reacción química hay absorción o desprendimiento de energía, fenómenos que deben indicarse en la ecuación.
Las reacciones endotérmicas, reacciones en las que se absorbe calor, se representan así:
2H2O(I) + 136 Kcal → 2H2(g) + O2(g)
Las reacciones exotérmicas, reacciones en las que se desprende calor, se representan así:
2H2(g) + O2(g) → 2H2O(l) + 136 Kcal
4. La ecuación química debe estar balanceada: los mismos átomos de cada elemento han de figurar en el primer miembro y en el segundo.
La siguiente ecuación no está balanceada.
N2 + H2 → NH3
En los reactivos hay dos átomos de nitrógeno y sólo uno en el producto. Para ajustar el nitrógeno es necesario tomar dos moléculas de amoniaco, lo cual se indica con un coeficiente 2 colocado antes de la fórmula de dicho compuesto:
N2 + 3H2 → 2NH3
El ajuste de la ecuación se ha realizado por tanteo. Existen mejores métodos para balancear una ecuación; estos se verán luego.
5. En una ecuación química cada fórmula representa, no una molécula sino un número fijo de ellas que es el número de Avogadro. En otras palabras, cada fórmula representa una mol.
Obsérvese cómo se interpreta la siguiente ecuación química:
4NH3 + 3O2 → 2N2 + 6H2O |
| 4 moléculas | 3 moléculas | 2 moléculas | 6 moléculas |
| 4 moles | 3 moles | 2 moles | 6 moles |
| Peso de las 4 moles de NH3 68 g | Peso de 3 moles de O2 96 g | Peso de 2 moles de N2 56 g | Peso de 6 moles de H2O 108g |
Peso total de los reactivos: 68 g + 96 = 164 g | Peso total de los productos: 56 g + 108 g = 164 g |
REACCIONES MOLECULARES
Son aquellas donde intervienen sustancias con enlaces covalentes.
En este tipo se reacción, en las moléculas de los reactivos se produce la rotura de algunos de sus enlaces, para dar lugar a la formación de otros nuevos productos. Las reacciones se verifican en estado gaseoso, líquido o en disolución:
CH4 + 2O2 → CO2 + 2H2O
REACCIONES IÓNICAS
Son aquellas donde intervienen compuestos iónicos, los cuales no aportan moléculas sino iones.
Cuando un compuesto iónico se disuelve en agua, los iones que lo constituyen se separan, fenómeno que recibe el nombre de ionización.
NaCl → Na+ + CL-
Por está razón, las reacciones iónicas tienen lugar en disolución, donde los iones se desplazan con libertad, lo cual facilita el encuentro de los que reaccionan entre sí.
REACCIONES IÓNICAS DE PRECIPITACIÓN
Las reacciones de precipitación ocurren cuando iones de signo contrario se unen para formar una sustancia insoluble o precipitado, que termina depositándose en el fondo del recipiente.
K+ + Cl- + Ag+ + NO3- → AgCl + KNO3
El proceso fundamental de la reacción anterior es la formación del precipitado de AgCl. Los iones K+ y NO3- no intervienen, por lo cual reciben el nombre de iones espectadores.
ECUACIÓN IÓNICA NETA
2Ag+ + 2Cl- → 2AgCl(s)
ECUACIÓN IÓNICA NETA ES
El AgCl no se escribe en forma iónica, porque en estado sólido, los iones no pueden moverse libremente.
PREGUNTA: Cuando en la reacción química se indica los enlaces covalentes que participan, se habla de:
Leyes ponderales en las reacciones químicas
Las siguientes leyes rigen el comportamiento de la materia en cuanto a los pesos de las sustancias que intervienen en una reacción:
1. Ley de la conservación de la materia, de Lavoisier:
La materia no se crea ni se destruye, únicamente se transforma.
En una reacción química no hay pérdida ni aumento de masa, por que la masa de los reactivos es igual a la de los productos.
Para que una ecuación química cumpla esta ley, se requiere que haya exactamente el mismo número de átomos a cada lado de la ecuación.
H2 + O2 → H2O No esta balanceada, no cumple la ley.
2H2 + O2 → 2H2O Está balanceada, cumple la ley.
2. Ley de la combinación constante, Proust:
Cualquier compuesto químico puro tiene una composición constante en masa.
La tabla muestra algunos ejemplos:
Composición dada en porcentajes de algunos compuestos.
| Compuesto | Composición |
| Agua H2O | 88.8% oxígeno, 11.2% hidrógeno |
| Cloruro de Sodio NaCl | 39.3% sodio, 60.7% cloro |
| Metano, CH4 | 75% carbono, 25% hidrógeno |
LEY DE LAS PROPORCIONES MÚLTIPLES DE DALTÓN:
La ley de Dalton o ley de las proporciones múltiples formulada en 1803 por John Dalton, es una de las leyes estequiométricas más básicas.
Esta ley afirma que cuando dos elementos se combinan para originar diferentes compuestos, dada una cantidad fija de uno de ellos, las diferentes cantidades del otro se combinan con dicha cantidad fija para dar como producto los compuestos, están en relación de números enteros sencillos.
Es decir, que cuando dos elementos A y B forman más de un compuesto, las cantidades de A que se combinan en estos compuestos, con una cantidad fija de B, están en relación de números enteros sencillos.
Esta fue la última de las leyes ponderales en postularse. Dalton trabajó en un fenómeno del que Proust no se había percatado, y es el hecho de que existen algunos elementos que pueden relacionarse entre sí en distintas proporciones para formar distintos compuestos.
Esta Ley de Dalton establece que las presiones totales de una mezcla de gases es igual a la suma de las presiones parciales de cada uno de los componentes de la mezcla.
Pt = Pa + Pb + ... + Pn
Pt: Presión total. Pa + Pb + Pn: son las presiones parciales de los gases a, b, n
Por ejemplo, el cuadro muestra lo que ocurre con la composicion del CO y el CO2 .
Compuesto | Cantidad de Carbono | Cantidad de oxigeno | Relación entre las masas de oxigeno que se combinan con 12 g de carbono |
CO | 12 gr | 16 gr | 16:32 o 1:2 |
CO2 | 12 gr | 32 gr |
PREGUNTA: La materia no se crea ni se destruye, únicamente se transforma; es un postulado de:
Cómo balancear ecuaciones por el método de óxido - reducción o redox
Método de óxido - reducción
Reacciones de óxido-reducción son las que presentan transferencias de electrones y por consiguiente, cambio en el número de oxidación de los reactivos.
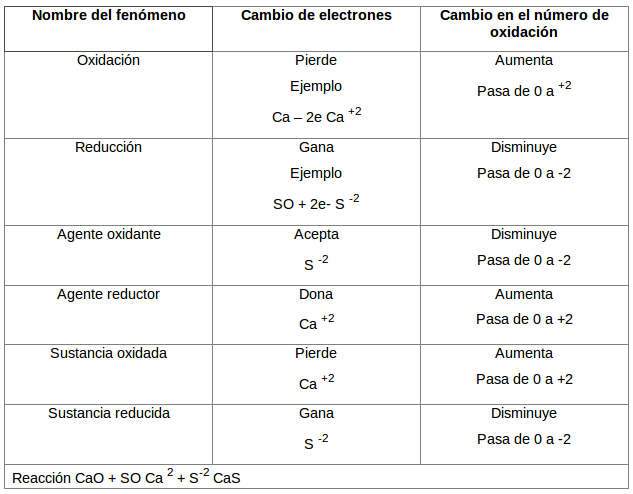
Según la tabla podemos concluir que:
El calcio (Ca): Es el agente reductor y la sustancia oxidada. Agente reductor porque produce la reducción del azufre S, es decir cede electrones para oxidarse.
El azufre (S): Es el agente oxidante y la sustancia reducida. Agente oxidante porque produce la oxidación de calcio (Ca), capta electrones para reducirse.
El número total de electrones perdido por una sustancia en la oxidación es igual al número de electrones ganados por otra sustancia en la reducción.
Reglas para balancear por el método de óxido - reducción
Sigue los pasos en el orden que se proponen. Una vez tengas alguna práctica puedes omitir algunos pasos para abreviar el procedimiento.
A continuación se describe el método y se ilustra simultáneamente con un ejemplo:
1. escribe correctamente la ecuación química que vas a balancea:
Fe2O3 + CO → Fe + CO2
2. Determina y asigna los números de oxidación a cada uno de los átomos de las sustancias que actúan como reactantes y productos.
Fe+32+O-23 + C+2+O-2 → Fe0 + C+4+O-22
3. Identifica cuáles átomos se han oxidado y cuáles se han reducido.
En esta ecuación, el Fe disminuye su número de oxidación de (+3 a 0), el cambio es de (-3e-). Esto significa que el hierro se redujo o sea ganó 3e-, al contrario, el carbono aumentó su número de oxidación de (+2 a +4), el cambio fue de (+2e-). El carbono se óxido. El oxígeno no cambia su número de oxidación.
4. Usa líneas de conexión entre los átomos que se han oxidado y los que se han reducido. Escribe el cambio en el número de oxidación en el punto medio de cada línea.
5. Multiplica el número de electrones por factores adecuados para que el número total de electrones ganados sea igual al número de electrones cedidos. En el ejemplo, el número de oxidación que disminuyó (Fe) se multiplica por 2 y el número de oxidación que aumentó (C) se multiplica por 3. De esta manera, el número de electrones cedido es -6 y el número de electrones ganados es +6 .Para balancear la ecuación, coloca el coeficiente 3 al Frente de la molécula de CO y CO2. Para nivelar el Fe simplemente, coloca 2 al frente de Fe. A la molécula de Fe2O3 no es necesario colocarle ningún coeficiente pues esta indicando 2Fe.
6. Finalmente, revisa la ecuación para que estés seguro que está bien balanceada. Si es necesario termina de balancear la ecuación por la simple inspección o tanteo.
PREGUNTA: ¿Cuáles son las reacciones que presentan transferencias de electrones y por consiguiente, cambio en el número de oxidación de los reactivos?
MÉTODO DE TANTEO O INSPECCIÓN
Cuando las ecuaciones son sencillas, se colocan coeficientes a la izquierda de cada sustancia hasta tener igual número de átomos tanto en los reactivos como en los productos. Para que el método funcione es necesario seguir el siguiente orden: primero se balancea el metal, luego el no metal, a continuación el oxigeno y por último el hidrógeno.
Observa el siguiente el ejemplo:

Estequiometría
¿Qué es estequiometría?
La estequiometría se encarga de hacer cálculos matemáticos a partir de ecuaciones químicas balanceadas. Una ecuación química balanceada permite averiguar las cantidades de reaccionantes que se requieren para formar cierta cantidad de producto.
Los cálculos estequiométricos se basan en las relaciones fijas de combinación que hay entre las sustancias. Dichas relaciones están indicadas por los índices numéricos que aparecen en las fórmulas y por los coeficientes de la ecuaciones balanceadas.
Los cálculos estequiométricos requieren una unidad química que relacione los pesos de los reactantes con los pesos de los productos. Esta unidad es la mol.
Una mol es una cantidad de material que contiene el numero de Avogadro de partículas: 6.02 x 10 23. Una mol corresponde en gramos, al peso fórmula (peso atómico o molecular) de una sustancia. Por ejemplo, una mol de SO2 pesa
Una mol de átomos de Hidrógeno contiene 6.02 x 1023 átomos de este elemento y su peso es 1 gr.
Número de moles
El número de moles se refiere a la cantidad de estas unidades presentes en una muestra. Se representa con la letra n.
Para calcular el número de moles se divide el valor en gramos de la muestra por el valor de un mol de dicha muestra. Es decir,
n = gramos de la muestra ÷ valor de 1 mol de la muestra
En
peso molecular = 32 + 48 = 80 gr/mol
Cálculos que se pueden obtener de una ecuación química
De una ecuación se obtiene:
- La cantidad de producto que se puede preparar a partir de ciertas cantidades de reactivos.
- El reactivo límite, el cual determina que tanto producto se puede obtener de una ecuación química, cuando no se dispone de una cantidad limitada de uno de los reactivos.
- Los porcentajes de producción.
- La pureza del compuesto.
a) ¿Cómo hallar la cantidad de un producto que se puede preparar a partir de ciertas cantidades de reactivos?
Una reacción química balanceada indica la cantidad exacta de producto que se obtiene a partir de cantidades exactas de reactivos. Por ejemplo:
2 KClO3 → 2KCl + 3O2
Esta reacción indica que 2 moles de KClO3 producen 2 moles de KCl y 3 moles de O2 . Si el análisis se hace en gramos, se establece que 245 gr de KClO3 producen 149 gr de KCl y 96 gr de O2.
b) ¿Cómo se halla un reactivo límite?
Reactivo límite es la sustancia que al estar en menor proporción, se agota primero que las demás, suspendiendo la marcha de la reacción.
Obsérvese la siguiente reacción:
MgO + 2HCl → MgCl2 + H2O
Una mol de MgO se combina con 2 moles de HCl para formar una mol de MgCl2 y una mol de H2O. Con una mol de MgO y 10 moles de HCl, se producirá exactamente la misma cantidad anterior. En este caso, sin importar la cantidad de HCl presente, el MgO limita la cantidad de MgCl2 y H2O que puede producirse. El MgO es el reactivo limite.
También puede suceder lo contrario. Si hay exceso de MgO y muy poca cantidad de HCl, el HCl es el reactivo limite.
c) ¿Cómo hallar los porcentajes de producción en una reacción química?
Las ecuaciones químicas presentan situaciones de rendimiento que son reales: un resultado es el teórico y otro el que se obtiene experimentalmente. Un rendimiento teórico se obtiene de los datos expresados en la ecuación y corresponden al 100 % de eficiencia.
El rendimiento real esta dado por la cantidad de producto obtenido experimentalmente, el cual es inferior al 100%.
d) ¿Cómo se halla la pureza de un compuesto producido en una reacción química?
No todas las sustancias con que se trabaja en química, o que se producen en una reacción son 100 % puras. Es necesario tener en cuentas las impurezas. Si el NaCl tiene un 90% de pureza significa que 90% es realmente sal: el 10% son impurezas.
PREGUNTA: Una mol de H2O contiene:
a) 2 moles de H2O
b) 32 g/mol
c) No. Avogadro
d) Ninguna
Segunda parte de estequiometría
En otras palabras:
La estequiometría se refiere a la determinaciones de cantidades de reactivos o productos en una ecuación química balanceada.
Tomemos una de las ecuaciones balanceadas:
2HNO3 + 3H2S → 2NO + 3S + 4H2O
Esta ecuación se lee así:
Si dos moles de HNO3 reaccionan con tres moles de H2S producen 2 moles de NO, 3 moles de S y 4 moles de H2O.
Si queremos esta misma información pero dada en gramos, se deben hacer las siguientes conversiones:
Para HNO3
Para el H2S :
Para el NO
Para el S
Para el H2O:
Tomando nuevamente la ecuación inicial 1. y teniendo en cuenta los resultados anteriores, tenemos que:
Si
Que harias si no se contara con esas cantidades exactas de reactivos de HNO3 y H2S en el laboratorio?, ò si solo necesitaras producir 10 gr de S.
Nota. Para convertir los gramos de HNO3 en milímetros de HNO3 se utiliza el valor de su densidad.
Nuestro problema es entonces de cantidades. Cuando en química se requiere este tipo de cálculos hablamos de ESTEQUIOMETRIA.
Resolvamos el interrogante planteado:
¿Como producimos
Según la ecuación
1. 2HNO3 + 3H2S → 2NO + 3S + 4H2O
2. 126g HNO3 +
Como la pregunta esta formulada en gramos utilizamos la ecuación dos
Se necesitan
Se necesitan
- Conclusión:
Si hago reaccionar 13.125 g de HNO3 con
PREGUNTA: Supóngase que 0,52 moles de Fe reaccionan con 0.8 moles de O2 para formar el producto óxido de hierro (III), Fe2O3. ¿Qué elemento queda en exceso, y en qué cantidad?
El hierro se encuentra en exceso en una cantidad
de 0,01 moles.
El oxígeno se encuentra en exceso en una cantidad
de 0,01 moles.
El oxígeno se encuentra en exceso en una cantidad
de 0,4 moles.
El hierro se encuentra en exceso en una cantidad
de 0,02 moles.




Comentarios
Publicar un comentario