Quimica 11º
¿Qué es la química organica?
En los últimos años del siglo XVIII y a principios del siglo XIX, muchos químicos centraron su atención en la separación, purificación e identificación de sustancias aisladas de animales o plantas. Pronto se dieron cuenta de que los compuestos de este origen poseían en común ciertas propiedades que los distinguían de aquellos obtenidos de fuentes minerales. Por ejemplo, Las sustancias extraídas de animales o plantas son por lo general combustibles, tienden a fundirse o descomponerse a temperaturas relativamente bajas (
Debido a su procedencia de los organismos vivos, dichos compuestos fueron considerados como compuestos orgánicos y la rama de la química que se dedicaba a su estudio se denomino Química orgánica.
Por muchos años se pensó que los compuestos orgánicos no podían ser sintetizados en el laboratorio porque tenían algo así como una fuerza vital que impedía su formación en fuentes distintas a las naturales. En 1828, sin embargo, el químico alemán Friedrich Wohler ( 1800- 1882) logro obtener urea, un compuesto presente en la orina – a partir de cianato de amonio, lo que presento la conversión de una sustancia inorgánica en otra orgánica. Este y otros experimentos posteriores desacreditaron gradualmente la teoría de la fuerza vital (también conocida como teoría vitalista) y abrieron el campo para la síntesis de nuevos compuestos orgánicos.
En la actualidad, el número de compuestos orgánicos preparados artificialmente es mucho mayor que el de obtenidos de fuentes naturales. Tanto los unos como los otros, tienen como constituyente fundamental el carbono, por lo que se les conoce conjuntamente como compuestos del carbono. Sin embargo, es todavía más común el nombre tradicional de compuestos orgánicos para estos compuestos y la química orgánica para el estudio de los mismos, sean de origen natural o no. Por consiguiente, podemos considerar que la química orgánica es la rama de la química que se dedica al estudio de los compuestos del carbono.
Importancia de la química orgánica
La química orgánica se relaciona con nuestra vida cotidiana probablemente más que cualquier otro rama de la ciencia. Los alimentos que comemos, los vestidos que usamos, la madera y papel de muebles y libros, las medicinas que ingerimos, los plásticos que utilizamos en las variadas aplicaciones, las gasolinas aceites y lubricantes, el caucho de las llantas de aviones y automóviles, y, en fin, una larga lista de productos, todos ellos de innegable familiaridad, son compuestos orgánicos. Hablar de la importancia de su estudio es casi una redundancia.
El átomo de carbono
El carbono es un elemento que solo ocupa el duodécimo lugar de abundancia en la tierra (menos del 0.1 %), considerando la corteza terrestre, el agua de ríos, lagos y océanos y el aires que constituye la atmósfera. Sin embargo, es el que forma el mayor número de compuestos, muchos más que los de todos los demás elementos juntos.
El átomo de carbono pertenece al grupo 4A de la tabla periódica, lo que indica que tiene cuatro electrones de valencia y que puede completar su octeto cuando comparte dichos electrones, ya sea con otros átomos de carbonos o con átomo de un elemento distinto. En otras palabras el carbono forma cuatro enlaces covalentes.
Siendo su distribución electrónica espacial 1s2 2s2 2p2 vemos que la capa externa del carbono corresponde al nivel dos donde se presentan cuatro electrones de valencia, con dos subniveles (uno s y otro p); el subnivel 2s está lleno y el subnivel 2p tiene dos orbitales semillenos y uno de ellos está vacío ( ver figura 1) . Los cuatros electrones de valencia del carbono se distribuyen de tal forma en su hibridación, que pasan a ser todos equivalentes dentro de sus orbítales atómicos y así, el carbono puede unirse mediante cuatro enlaces covalentes sencillos con átomos iguales o diferentes hecho conocido como tetravalencia (hecho que se explica más adelante).
Figura1.Distribución electrónica del carbono
Teoría de hibridación
Como ya se mencionó la configuración electrónica anterior (figura 1). En la que se presenta el átomo de carbono en su estado normal o básico. Al entrar en combinación, uno de los dos electrones de tipo 2s adquiere un poco mas de energía, la suficiente para llegar a ser un electrón de tipo p, y pasar a ocupar el orbital 2pz, inicialmente vació. Decimos entonces que hubo una promoción del electrón y que el átomo pasó de su estado fundamental a un estado excitado. Gráficamente tenemos:
Estado fundamental: 1s2 2s2 2px1 2py1
Estado excitado: 1s2 2s2 2px1 2py1 2pz 1
En su estado excitado, el carbono presenta sus cuatro electrones de valencia desapareados y, por tanto, está en capacidad de formar cuatro enlaces, como es el hecho real. En términos sencillos la teoría de hibridación considera que en la formación de enlaces los átomos no siempre participan con sus electrones ubicados en orbitales atómicos normales, sino que las características de los electrones cambian de tal manera que continúan moviéndose en espacios un poco diferentes conocidos como orbitales híbridos. Podríamos decir que los orbitales atómicos originales se mezclan o reestructuran para formar los orbitales híbridos. La forma y orientación de los orbitales híbridos depende de cuales sean los orbitales atómicos que participan en la hibridación, como se explicara más adelante.
Pregunta. La teoría de la tetravalencia indica que el átomo de carbono puede formar 4 enlace por que:
* Tiene los orbitales y
suborbitales completos.
* El átomo de carbono tiene el
subnivel 2s lleno y el subnivel 2p tiene dos orbitales semillenos y uno está
vacío.
* Todas las anteriores.
* El suborbital p tiene lo
orbitales vacíos.
Concepto de hibridación
La hibridación consiste en una mezcla de orbitales puros en un estado excitado para formar orbitales híbridos equivalentes con orientaciones determinadas en el espacio. Estos cambios se presentan entre los orbitales de un mismo nivel de energía; lo que significa que en el átomo de carbono se presenta en la última capa electrónica correspondiente al nivel dos involucrando a los subniveles 2s2 y 2p2. A los orbitales híbridos que se forman se le conoce como sp, sp2, sp3.
Hibridación tetraédrica Sp3
Se presenta en los átomos de carbono con enlaces simples o uniones sencillas (alcanos). Se da cuando se combinan los tres orbitales 2p (y, x , z) con el orbital 2s formando cuatro nuevos orbitales moleculares denominados sp3 .
La figura resultante es un tetraedro donde su núcleo se halla en el centro y sus cuatros electrones de valencia están situados en los vértices formando entre si un angulo de 109, 5°. De esta manera, cada uno de los cuatro orbitales híbridos sp³ del carbono puede enlazarse a otros 4 átomos, así se explica la tetravalencia del átomo de carbono.
Debido a su condición híbrida, y por disponer de 4 electrones de valencia para formar enlaces covalentes sencillos, pueden formar entre sí cadenas con una variedad ilimitada entre ellas: cadenas lineales, ramificadas, anillos, etc. A los enlaces sencillos –C-C- se les conoce como enlaces sigma σ.
Hibridación trigonal Sp2
Se presenta en los átomos de carbono con enlaces dobles. En esta hibridación sólo se combinan los dos orbitales 2p (x, y) con el orbital 2s para formar únicamente tres orbitales híbridos sp2, quedando sin hibridar uno de los orbitales 2p (z) con su electrón disponible. El orbital no hibridado queda perpendicular al plano de los 3 orbitales sp² que al unir Imaginariamente forma una pirámide de base triangular que da el nombre a la hibridación. A este doble enlace se le denomina π (pi). Este enlace es más débil que el enlace σ (sigma), y por tanto, más reactivo. Cuando ocurre un enlace doble, los cuatro enlaces de cada carbono ya no se dirigen a los vértices de un tetraedro, sino que forman un angulo de 120º entre si, estando todos los enlaces en un mismo vértice.
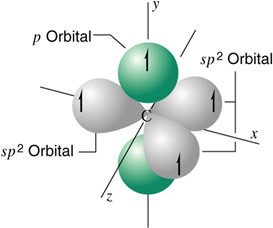
Átomo de carbono hibridizado sp2
El carbono hibridado sp2 da lugar a la serie de los alquenos.
Hibridación digonal sp
Se presenta en presenta en los átomos de carbono con enlaces triples. Los átomos que se hibridan ponen en juego un orbital s y uno p, para dar dos orbitales híbridos sp, colineales formando un ángulo de 180º. Los otros dos orbitales p no experimentan ningún tipo de perturbación en su configuración.
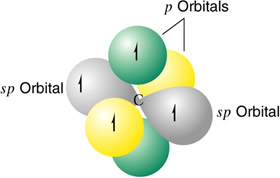
Un átomo de carbono hibridizado sp. El carbono hibridado sp da lugar a la serie de los alquinos.
Resumen de los Tipos de hibridación del carbono
Tipo de hibridación | Orbitales | Geometría | Ángulos | Enlace |
sp3 | 4 sp3 | Tetraédrica | 109º | Sencillo |
sp2 | 3 sp2 | Trigonal plana | 120º | Doble |
sp | 2 sp2 p | Lineal | 180º | Triple |
En resumen:
Cuando los cuatro enlaces del carbono son simples, los ángulos de enlace son de 109.5º y la estructura es tetraedral. El enlace simple son de tipo Sigma (σ ) y por tanto , de naturaleza bastante fuerte.
Cuando hay un enlace doble, los ángulos de enlace son de 120º y la estructura es planar. Los carbonos son trigonales. El enlace doble esta constituido por un enlace sigma fuerte y otro pi, más débil.
Cuando hay un triple enlace, los ángulos son de 180º y la estructura es lineal. Los carbonos son digonales . El enlace triple, esta conformado por un enlace sigma fuerte y dos enlaces pi similares (débiles).
PREGUNTA: Los enlaces simples carbono-carbono son de tipo:
* Dos enlaces sigma.
* Tipo sigma y uno Pi.
* Tipo sigma.
* Enlaces Pi.
Estructura de los compuestos orgánicos
Cadenas y estructuras
En los compuestos orgánicos los átomos de carbono se unen entre si para formar cadenas que pueden alcanzar longitudes considerables. Estas cadenas pueden ser abiertas o cíclicas.
CADENAS NORMALES
Son cadenas abiertas continuas y se conocen también como lineales por que generalmente se escriben en línea recta. Por ejemplo:
Sin embargo , conviene tener siempre presente que la cadenas de esta forma no existen en realidad , pues, como sabemos , los enlaces establecidos por el carbono forman entre si ángulos de 109,5 º lo que hace imposible la línea recta . Esta representación que por comodidad, es la que utilizamos comúnmente – no es más que una simplificación de la estructura.
Ahora bien, los enlaces simples carbono-carbono permiten rotaciones y, en consecuencias, las cadenas cambian de forma o, mas exactamente, de conformación.
Conviene en este punto dejar muy clara la diferencia entre dos conceptos que hemos mencionado.
Estructura: Se refiere al orden o secuencia como están unidos los átomos en una molécula y a la naturaleza de los enlaces que unen dichos átomos.
Conformación: Por su parte, tiene que ve con las distintas formas o presentaciones que puede adoptar una molécula por rotación de sus átomos alrededor de los enlaces simples. Los enlaces dobles y triples no permiten dicha rotación.
Lo común es que las cadenas normales se escriban en línea recta. Ahora bien no siempre consisten exclusivamente de enlaces simples: los dobles y triples pueden estar presentes. Por ejemplo:
ESTRUCTURA RAMIFICADAS: Con mucha frecuencia encontramos que en algún carbono de una cadena se ha pegado otra, que llamamos ramificación, cadena secundaria o grupo sustituyente. El resultado es una estructura ramificada, por ejemplo:
CICLOS O ANILLOS
Son cadenas que se cierran para formar este tipo de estructuras. Por ejemplo:
Digamos finalmente que otros átomos distintos al carbono-carbono – por lo común referidos como heteroatomos- pueden hacer parte de las cadenas. Los más importantes son los siguientes, con el respectivo número de enlaces que forman usualmente:
Es de advertir que los halógenos, por disponer de una sola posibilidad de enlace, no pueden ser parte integral de una cadena, a no ser en los extremos o como sustituyentes, por ejemplo:
PREGUNTA: Los ciclos o anillos se caracterizan por ser:
Clasificación de los compuestos orgánicos
Grupo funcional: Determinante del comportamiento químico
Los compuestos orgánicos son muchos más numerosos que los inorgánicos. Estos alcanzan a unos 100.000, mientras que los orgánicos sobrepasan los dos millones. Obviamente no podemos estudiarlos uno por uno. Para hacerlo debemos reunir aquellos compuestos que presentan un comportamiento químico similar , y analizar las características estructurales que le son comunes a cada grupo.
Al proceder así, se encuentra que todos los compuestos de propiedades químicas semejantes poseen un mismo conjunto de átomos en sus moléculas. Este conjunto o grupo de átomos que determina el comportamiento químico de una clase de compuestos recibe el nombre de grupo funcional. Cada clase de compuestos se denomina función
Así, por ejemplo, los alcoholes constituyen la función alcohol y presentan el grupo funcional OH. Veamos:
El grupo funcional es, por consiguiente, el centro reactivo de la molécula. En las reacciones químicas, es este grupo el que se modifica, permaneciendo intacto el resto de la molécula en la mayoría de los casos.
En la tabla 1 se indican los principales grupos funcionales de la quimica orgánica
Funciones orgánica
De esta manera el estudio de los compuestos orgánicos se simplifica enormemente. Ya no son dos o tres millones de sustancias diferentes, si no veinticinco o treinta clases de compuestos de propiedades afines. Basta conocer cuáles son estas para aplicarlas en general a todos los miembros de una misma clase.
En
Se incluye también en la tabla un ejemplo de cada función, simplemente para ilustrar la presencia del grupo funcional en una molécula real. No se pretende acá que el estudiante memorice las formulas y nombres de estos ejemplos, ya que esto será tratado a medida que se vaya considerando cada una de las funciones.
PREGUNTA: En el siguiente compuesto CH3-O-CH3 señale, ¿cuál es el grupo funcional? A) ETER B) ESTER C) OXIGENO
Concepto de hidrocarburos
HIDROCARBUROS
Los hidrocarburos son compuestos bioquímicos formados únicamente por carbono e hidrógeno. Consisten en un armazón de carbono al que se unen átomos de hidrógeno. Forman el esqueleto de la materia orgánica.
Los hidrocarburos y sus compuestos derivados se pueden clasificar en general en tres grandes categorías:
1. Hidrocarburos alifáticos acìclicos, formados por cadenas de átomos de carbono en las que no hay estructuras cíclicas como los alcanos,alquenos y alquinos. Se les denominan en general, hidrocarburos de cadena abierta o acíclicos ( las cadenas pueden ser lineales y ramificadas ).
CH3-CH2-CH3 propano | CH3-CH2-CH2-CH2-CH3 pentano | CH3-CH=CH-CH3 2-buteno |
2. Hidrocarburos alifàticos alicíclicos: compuestos por átomos de carbono encadenados formando uno o varios anillos. En este grupo encontramos los clicloalcanos,terpenos y otros.
3. Hidrocarburos aromáticos, que constituyen un grupo especial de compuestos cíclicos que contienen en general anillos de seis eslabones en los cuales alternan enlaces sencillos y dobles. Se clasifican, independientemente de los hidrocarburos alifáticos acìclicos y alicíclicos, por sus propiedades físicas y químicas muy características.
Los hidrocarburos extraídos directamente de formaciones geológicas en estado líquido se conocen comúnmente con el nombre de petróleo, mientras que a los que se encuentran en estado gaseoso se les conoce como gas natural. Los hidrocarburos constituyen una actividad económica de primera importancia, pues forman parte de los principales combustibles fósiles (petróleo y gas natural), así como de todo tipo de plásticos, ceras y lubricante.
PREGUNTA. Los hidrocarburos se clasifican en:
Los Alcanos
Los alcanos son hidrocarburos simples que tienen sólo átomos de carbono e hidrógeno y contienen enlaces sencillos de carbono-carbono es decir, están formados únicamente por enlaces simples, esto es, de tipo sigma. Sus carbonos están hibridados tetraedalmente por lo que tanto los enlaces carbono-carbono como los carbono-hidrogeno están dirigidos hacia los vértices de un tetraedro, formado entre sí ángulos de 109,5º. Estos hidrocarburos tienen como formula general C n H2n+2. Así, entonces, si el alcano tiene 5 carbonos, su formula molecular seria C5 H12, donde n es el numero de carbonos de la molécula. El hidrocarburo más simple es el metano CH 4 (n=1) con un solo átomo de carbono. Otros alcanos conocidos son el etano, propano y el butano con dos, tres y cuatro átomos de carbono respectivamente.
Isomería de los alcanos
Los alcanos presentan una propiedad denominada isomería, que consiste en las diferentes formas de ordenarse los átomos geométrica y topológicamente dentro de la molécula, de forma que dos moléculas con la misma fórmula molecular pueden presentar estructuras y por tanto propiedades físicas y químicas diferentes, así entonces, existen dos isómeros del butano (el normal y el iso) pero la cantidad va aumentando a medida que se incrementa el numero de carbonos. Por ejemplo, son 6 los isómeros de formula C6H14 y 75 de formula C10H22; para el tetracontano, C40H82, los isómeros posibles alcanzan la increíble cifra de
CH3-CH2-CH2-CH2-CH2-CH3 n-hexano.
Como este tipo de isómeros se diferencian en su estructura, se dice que son isómeros estructurales y, es más, son isómeros estructurales de cadena, ya que las distintas estructuras se originan por una reorganización de la cadena carbonada.
Propiedades físicas de los alcanos
Los alcanos se presentan en estado sólido, líquido o gaseoso según el tamaño de la cadena de carbonos. Hasta 4 carbonos son gases (metano, etano, propano y butano), a partir del pentano hasta el hexadecano (16 carbonos) son líquidos y los compuestos superiores a 16 carbonos se presentan como sólidos aceitosos (parafinas). Su densidad es menor que la del agua, con un valor promedio de 0.7 g/ml para los líquidos, y son insolubles en ella. De aquí que la gasolina, los aceites lubricantes y otras mezclas ricas en alcanos floten en agua.
Obtención y usos de los alcanos
Los alcanos se obtienen fundamentalmente a partir del petróleo y del gas natural que lo acompaña. Este gas está constituido por metano (más del 70%) y etano, con menores proporciones de propano, butano y otros alcanos de mayor peso molecular. Contiene además, cantidades variables de dióxido de carbono.
El uso común de los alcanos no es como compuesto individuales, sino en forma de mezclas, ejemplo, gas natural gasolina, aceites lubricantes.
El propano y el butano se licuan con facilidad a temperaturas ambiente bajo presiones moderadas, lo cual permite su almacenamiento en cilindros de acero para ser utilizado como combustible domestico. Estos dos hidrocarburos han encontrado también aplicación como propelentes de aerosoles, en remplazo de los freones.
PREGUNTA. Los alcanos se conocen como:
REACCIONES DE LOS ALCANOS
La fortaleza de los enlaces sigma carbono-carbono, que son la esencia de la moléculas que son la esencia de las moléculas de los alcanos, hace que dichos compuestos sean muy inactivos desde el punto de vista químico. Por eso se les conoce también como parafinas, nombre derivado del latín ( parum affins ) que significa “ opuesto a afinidad o actividad.
La mayor parte de las reacciones de los alcanos tienen lugar a altas temperaturas y, por lo general, dan mezclas de productos difíciles de separar. La mas común es la que realizan con los halógenos que , si bien no son capaces de romper los enlaces carbono-carbono, si lo hacen con los enlaces carbono-hidrogeno. Esta reacción pertenece a la clase de reacciones de sustitución, ya que su efecto neto es el reemplazo de uno o mas átomos de hidrogeno. Veamos en mayor detalle:
1. Halogenaciòn de alcanos
Obedece a la siguiente ecuación general y se efectúa en presencia de luz o altas temperaturas:
Anque X representa cualquier halógeno en la ecuación general, lo usual es emplear el cloro o el bromo, ya que la reacción con flùor es muy violenta , en tanto que la sustitución por yodo requiere energía excesiva.
De otro lado, la reacción progresa hasta que se remplacen todos los hidrógenos, como se muestra en el ejemplo siguiente:
La reacción progresa hasta la sustitución de todos los hidrógenos:
El resultado total de
2. Oxidación o combustión de los alcanos
Los alcanos son bastantes resistentes a los oxidantes comunes como permanganato de potasio ( KMnO4 ) o dicromato de potasio ( K2 Cr2 O7 ).
Pero pueden ser oxidados a dióxido de carbono y agua cuando se encienden en presencia de un exceso de oxigeno. Como sabemos esta es una reacción de combustión y se caracteriza por liberar grandes cantidades de calor. Veamos:
CH4 (g) + 2 O2 (g) → CO2 (g) + 2H2O (g)
2C2H6 (g) + 7 O2 (g) → 4 CO2 + 6H2O (g)
La combustión de los alcanos y, en general, de los hidrocarburos, es al base de su extensa aplicación como combustible en motores, calentadores, etc.
PREGUNTA. Las reacciones de combustión se caracterizan por:
Nomenclatura de los Alcanos
Alcanos normales
Son los que no presentan ramificaciones , y a veces se identifican como n-alcanos por ejemplo n-butano para referirnos al compuesto CH3-CH2-CH2-CH3 . Estos hidrocarburos se nombran por una raíz o prefijo que indica el número de carbono y el sufijo ano, que identifica la función alcano. Los cuatros primeros prefijos no son propiamente de origen numérico, sino las raíces de los nombres de compuestos sumamente conocidos desde la antigüedad y son, en su orden, met, et, prop y but. De cinco carbonos en adelante si tienen prefijos numéricos de origen griego, como penta (5), hexa (6), etc.
| Fórmula estructural | Nombre | Fórmula condensada |
CH4 | metano | CH4 |
| CH3-CH3 | etano | C2H6 |
CH3-CH2-CH3 | propano | C3H8 |
| CH3-CH2-CH2-CH3 | butano | C4H10 |
| CH3-(CH2)3-CH3 | pentano | C5H12 |
CH3-(CH2)4-CH3 | hexano | C6H14 |
| CH3-(CH2)5-CH3 | heptano | C7H16 |
| CH3-(CH2)6-CH3 | octano | C8H18 |
CH3-(CH2)7-CH3 | nonano | C9H20 |
CH3(CH2)8-CH3 | decano | C10H22 |
Nomenclatura de alcanos ramificados
Los alcanos ramificados se derivan de los sistemas de cadena lineal por eliminación de un átomo de hidrógeno de un grupo metileno y sustitución por un grupo alquilo a lo que se denomina un Radical alquilo ( mas adelante se explica este término ).
Las reglas de nomenclatura para compuestos orgánicos e inorgánicos son establecidas por la Unión Internacional de Química pura y aplicada, IUPAC (de sus siglas en inglés).
A continuación se señalan las reglas para la nomenclatura de alcanos ramificados . Estas reglas constituyen la base de la nomenclatura de los compuestos orgánicos.
1. La base del nombre fundamental, es la cadena continua más larga de átomos de carbono.
2.- La numeración se inicia por el extremo más cercano a una ramificación. En caso de encontrar dos ramificaciones a la misma distancia, se empieza a numerar por el extremo más cercano a la ramificación de menor orden alfabético. Si se encuentran dos ramificaciones del mismo nombre a la misma distancia de cada uno de los extremos, se busca una tercera ramificación y se numera la cadena por el extremo más cercano a ella.
3.- Si se encuentran dos o más cadenas con el mismo número de átomos de carbono, se selecciona la que tenga el mayor numeros de ramificaciones . Si las dos tiene el mayor número de ramificaciones se escoge la cadena que al numerar sus ramificaciones tengan el numero más bajo.
4.- Cuando en un compuestos hay dos o más ramificaciones iguales,no se repite el nombre, se le añade un prefijo numeral. Los prefijos numerales son:
Número | Prefijo |
| 2 | di ó bi |
| 3 | tri |
| 4 | tetra |
| 5 | penta |
| 6 | hexa |
| 7 | hepta |
6.- Se escriben las ramificaciones en orden alfabético y el nombre del alcano que corresponda a la cadena principal, como una sola palabra junto con el último radical. Al ordenar alfabéticamente, los prefijos numerales y los prefijos n-, sec- y ter- no se toman en cuenta.
7.- Por convención, los números y las palabras se separan mediante un guión, y los números entre si, se separan por comas.
La comprensión y el uso adecuado de las reglas señaladas facilitan la escritura de nombres y fórmulas de compuestos orgánicos.
RADICALES ALQUILO
Cuando alguno de los alcanos pierde un átomo de hidrógeno se forma un radical alquilo. Estos radicales aparecen como ramificaciones sustituyendo átomos de hidrógeno en las cadenas.
Los radicales alquilo de uso más común son:
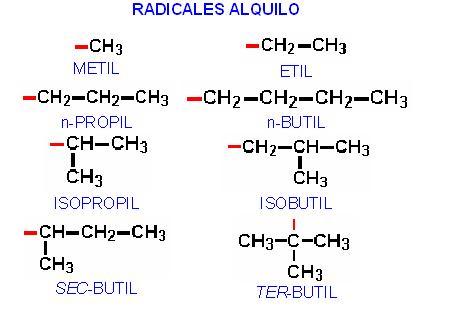
Las líneas rojas indican el enlace con el cual el radical se une a la cadena principal. Esto es muy importante, el radical no puede unirse por cualquiera de sus carbonos, sólo por el que tiene el enlace libre.
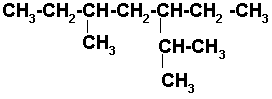
Ejemplos de nomenclatura de alcanos
1)
Buscamos la cadena de carbonos continua más larga y numeramos por el extremo más cercano a un radical, e identificamos los que están presentes.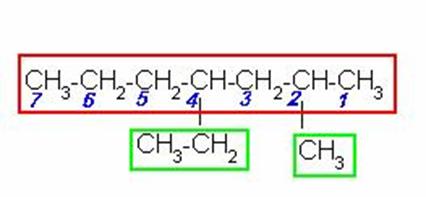
La cadena continua más larga tiene 7 carbonos y se empezó la numeración por el extremo derecho porque es el más cercano a un radical. . Identificamos los radicales y el número del carbono al que están unidos, los acomodamos en orden alfabético y unido el último radical al nombre de la cadena.
4-ETIL-2-METILHEPTANO
2)
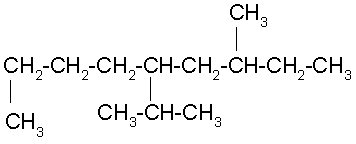
Buscamos la cadena continua de carbonos más larga, la cual no tiene que ser siempre horizontal. Numeramos por el extremo más cercano a un radical, que es el derecho. Ordenamos los radicales en orden alfabético y unimos el nombre de la cadena al último radical.
5-ISOPROPIL-3- METILNONANO
3)
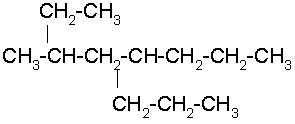
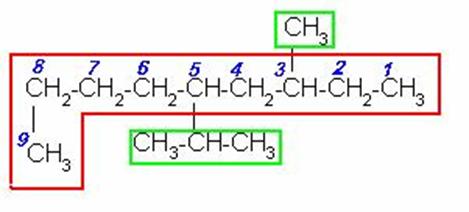
Buscamos la cadena de carbonos continua más larga, numeramos por el extremo mas cercano al primer radical, que en este caso es del lado izquierdo. Nombramos los radicales con su respectivo número en orden alfabético y unimos el nombre de la cadena la último radical.
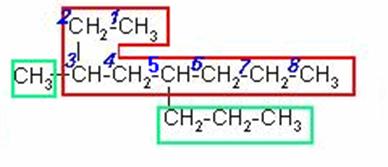
3-METIL-5-n-PROPILOCTANO
4)
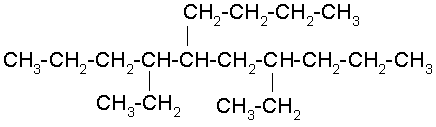
Selecciona la cadena continua de carbonos más larga. Al tratar de numerar observamos que a la misma distancia de ambos extremos hay un radical etil, entonces nos basamos en el siguiente radical, el n-butil para empezar a numerar.
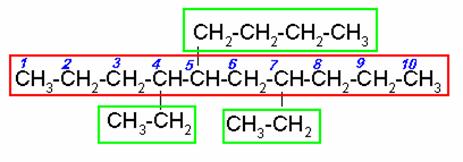
Recuerde que el n-butil por tener guión se acomoda de acuerdo a la letra b, y no con la n.
5-n –BUTIL-4,7-DIETILDECANO
5)
Al seleccionar la cadena de carbonos continua más larga observamos que a la misma distancia de cada extremo hay un radical, un metil y un etil, entonces iniciamos la numeración por el extremo más cercano al etil ya que es el radical de menor orden alfabético.
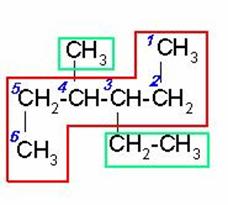
3-ETIL-4-METILHEXANO
EJEMPLOS DE NOMBRE A ESTRUCTURA
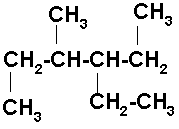
6) 3,4,6-TRIMETIL HEPTANO
La cadena heptano tiene 7 átomos de carbono. Los numeramos de izquierda a derecha, pero se puede hacer de derecha a izquierda. Ahora colocamos los radicales en el carbono que les corresponda. Tenga cuidado de colocar el radical por el enlace libre.
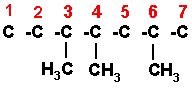
Como el carbono forma 4 enlaces, completamos nuestra estructura con los hidrógenos necesarios para que cada uno tenga sus 4 enlaces.
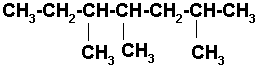
7) 3-METIL-5-ISOPROPILNONANO
Nonano es una cadena de 9 carbonos.
![]()
Colocamos los radicales
Los radicales pueden acomodarse de diferentes formas, siempre y cuando conserve su forma estructural.
Finalmente completamos con los hidrógenos necesarios para que cada carbono tenga sus 4 enlaces.
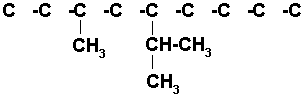
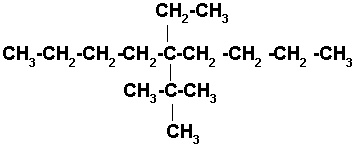
8)5-TER-BUTIL-5-ETILDECANO
Decano es una cadena de 10 carbonos.
![]()
Los dos radicales de la estructura están en el mismo carbono por lo tanto se coloca uno arriba y el otro abajo del carbono # 5, indistintamente.. Completamos con los hidrógenos
ENTRAR A ESTE LINK PARA PRACTICA DE LOA ALCANO
Nomenclatura de Halogenuros de Alquilo
La explicación sobre NOMENCLATURA , que se relaciona en esta lección, fue tomado de https://genesis.uag.mx/edmedia/material/quimicaII/Alcanos.cfm
Nomenclatura de Halogenuros de Alquilo
Los Halogenuros de Alquilo son compuestos que se caracterizan por que tienen de formula general RX, donde X es cualquier halógeno ( F,Cl,Br,I) y R es un radical alifático tipo CH3, CH3-CH2, etc. Para nombrarlo se agrega como prefijo el nombre del halógeno correspondiente (cloro, bromo, yodo o fluor) al nombre de alcano correspondiente. Ejemplo:
CH3 – Cl Clorometano
CH3 – CH2 – CH2 – Cl 1- Cloropropano
CH3 – CHBr – CH3 2-Bromopropano
Nomenclatura de haluros orgánicos
Estructuralmente los halogenuros de alquilo son compuestos formados por carbono, hidrógeno, uno o más átomos de halógeno y enlaces sencillos. La terminación sistémica de estos compuestos es ANO y por tanto son compuestos saturados.
En la nomenclatura sistémica, al seleccionar la cadena principal, el carbono o los carbonos unidos a alguno de los halógenos, deben formar parte de ella. En cuanto a la numeración:
- Se inicia por el extremo más cercano al halógeno.
- Si hay dos halógenos y están a la misma distancia de los extremos, se inicia por el más cercano al de menor orden alfabético.
- Si los halógeno son iguales y están a la misma distancia, nos basamos en otro halógeno si lo hay o en el radical alquilo más cercano.
Ejemplos de nomenclatura de haluros orgánicos
1)
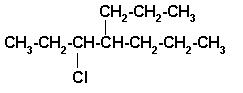
Seleccionar la cadena principal que contenga el carbono unido al cloro.
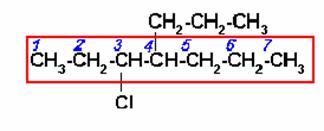
La numeración de la cadena se inicio por el extremo más cercano al átomo de cloro. En nombre del compuesto sería:
3-CLORO-4-n-PROPILHEPTANO
2)
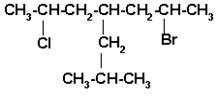
Seleccionar la cadena principal que contenga los dos átomos de carbono que están unidos a un átomo de halógeno (Cl y Br). Como los dos átomos están a la misma distancia de los extremos, elegimos el de menor orden alfabético para iniciar la numeración, o sea el bromo.
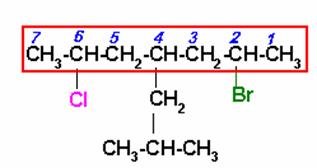
Nombrar los radicales en orden alfabético:
2-BROMO-6-CLORO-4-ISOBUTILHEPTANO
3)
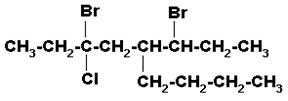
Seleccionar la cadena principal que contenga los carbonos unidos a átomos de halógenos. Al numerar, como los bromos están a igual distancia de los extremos, iniciar la numeración por el más cercano al cloro.
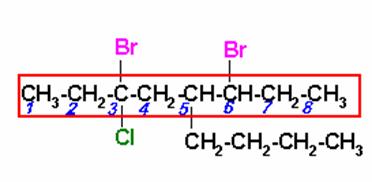
3.6-DIBROMO-5-n-BUTIL-3-CLOROOCTANO
4)
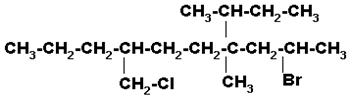
Seleccionar la cadena continua de carbonos más larga que incluya los carbonos unidos a los halógenos. Iniciamos la numeración por el extremo del cloro porque está más cerca que el bromo
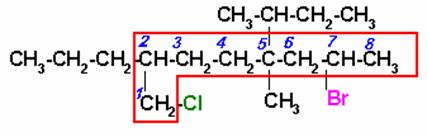
7-BROMO-5-SEC-BUTIL-1-CLORO-5-METIL-2-n-PROPILOCTANO
5)
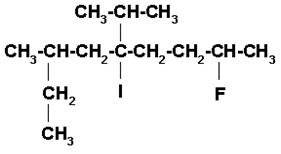
En esta estructura hay yodo y flúor. La cadena principal es la mas larga y que contenga los carbonos unidos al yodo y al flúor. Iniciamos la numeración por el extremo más cercano al flúor.
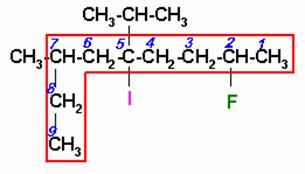
2-FLÚOR-3-ISOPROPIL-7-METIL-5-YODONONANO
Ejemplos de nombre a fórmula
7) 1,3,3,5-TETRACLORO-4-ISOBUTILHEXANO
La cadena tiene 6 carbonos que por acuerdo, numeramos de izquierda derecha.
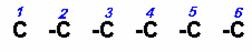
Colocamos los átomos de halógenos y el radical isobutil en los carbonos señalados.
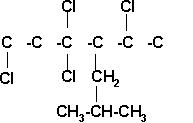
Completamos la estructura con los hidrógenos necesarios para que cada carbono tenga 4 enlaces.

PREGUNTA: ¿Cuál sería el nombre que corresponde a la siguiente estructura?: CH3-CH2-CH2-CH2-I
Alquenos
Los alquenos son hidrocarburos que tienen doble enlace carbono-carbono en su molécula, y por eso son denominados insaturados. La fórmula general es CnH2n. Se puede decir que:
Un alqueno no es más que un alcano que ha perdido un hidrógeno produciendo como resultado un enlace doble entre dos carbonos. Loa alquenos se conocen como oleofinas ( del latin: oleum: aceite y ficare: hacer), nombre que tuvo su origen en el aspecto aceitoso de los primeros derivados ,liquidos que se prepararon.
Al igual que ocurre con otros compuestos orgánicos, algunos alquenos se conocen todavía por sus nombres no sistemáticos, en cuyo caso se sustituye la terminación -eno sistemática por -ileno, como es el caso del eteno que en ocasiones se llama etileno, o propeno por propileno. Los alquenos cíclicos reciben el nombre de cicloalquenos.
Propiedades físicas
Los primeros cuatro miembros de la serie normal de los alquenos ( de 2 a 4 carbonos) son gases;del C5 al C15 en adelante son sólidos. Sus propiedades físicas son muy similares a la de los alacanos: son apolares, insolubles en agua y menos denso que ellas.
Estructura de alquenos
· Los dos carbonos del enlace doble y los cuatro átomos atados en un plano, forman un ángulo de 120°.
· El enlace doble consiste de un enlace sigma (s) sp2 y un enlace pi (p) 2p.
· Se requiere aproximadamente 264 kJ (63 cal / mol) para romper el enlace pi en etileno.
· Los alquenos tiene n rotación restringida, no pueden rotan en donde se encuentra el enlace doble y esto hace que se generen isomeros cis y trans los cuales provienen de la presencia de un anillo o un enlace doble.
- Los primeros tres compuestos, eteno (etileno), propeno y buteno, son gaseosos a temperatura ambiente; los siguientes son líquidos hasta los que tienen más de 16 carbonos que son sólidos.
- Son relativamente poco solubles en agua, pero solubles en ácido sulfúrico concentrado y en solventes no polares.
- Su densidad, punto de fusión y de ebullición se elevan conforme aumenta el peso molecular.
- El uso más importante de los alquenos es como materia prima para la elaboración de plásticos.
Alquenos de importancia
El etileno o eteno es un gas incoloro, insípido y de olor etéreo cuya fórmula es CH2=CH2. Se usan grandes cantidades de etileno (eteno) para la obtención del polietileno, que es un polímero. (sustancia formada por miles de moléculas más pequeñas que se conocen como monómeros). Por ejemplo del polietileno el monómero es el etileno. El polietileno es un compuesto utilizado en la fabricación de envolturas, recipiente, fibras, moldes, etc..
El etileno es utilizado en la maduración de frutos verdes como piñas y tomates. En la antigüedad se utilizó como anestésico (mezclado con oxígeno) y en la fabricación del gas mostaza (utilizado como gas de combate).
El propeno,(nombre común propileno), se utiliza para elaborar polipropileno y otros plásticos, alcohol isopropílico (utilizado para fricciones) y otros productos químicos.

Varias feromonas u hormonas sexuales de insectos, son alquenos.
Los carotenos y la vitamina A, constituyentes de los vegetales amarillos como la zanahoria, y que son utilizados por los bastoncillos visuales de los ojos, también son alquenos. El licopeno, pigmento rojo del jitomate, es un alqueno. Las xantinas colorantes amarillos del maíz y la yema de huevo, también son alquenos.
. El teflón es muy resistente a las acciones químicas y a las temperaturas altas, se elabora a partir de tetrafluoroetileno utilizando peróxido de hidrógeno como catalizador.
Pregunta. El doble enlace en los alquenos consiste de:
Nomenclatura de los Alquenos
La explicación sobre NOMENCLATURA , que se relaciona en esta lección, fue tomado de https://genesis.uag.mx/edmedia/material/quimicaII/Alcanos.cfm
NOMENCLATURA DE ALQUENOS
En la selección de la cadena más larga:
1.Los carbonos que forman el doble enlace, siempre deben formar parte de la cadena principal .
2. La numeración se inicia por el extremo más cercano al enlace doble.
3. Cuando existan varios enlaces dobles , su cantidad se indica por los prefijos númericos di, tri, etc..., según el caso, y su posición, por los números correspondientes a la cadena.
Ejemplo :
CH2=CH-CH=CH2 1,3-butadieno.
Al escribir el nombre de la cadena de acuerdo al número de átomo de carbonos, se antepone el número más chico de los dos átomos con el enlace doble y al final se escribe la terminación ENO.
Ejemplos:
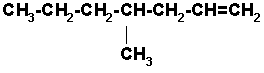
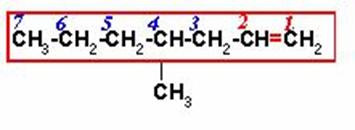
La cadena principal incluye los carbonos que forman el doble enlace y la numeración se inicia por el extremo más cercano al doble enlace. El nombre sería entonces:
4-METIL-1-HEPTENO
El alcano de 7 carbonos seria heptano, cambiamos la terminación ano por eno y como el doble enlace está entre los carbonos 1 y 2, se antepone el número 1 a la extensión de la cadena.
2)
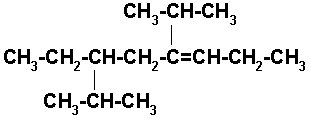
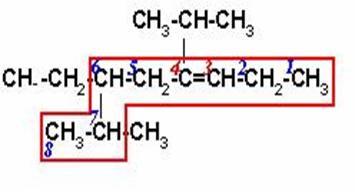
6-ETIL-4-ISOPROPIL-7-METIL-3-OCTENO
Seleccionamos la cadena más larga que contenga el doble enlace e iniciamos la numeración por el extremo más cercano al doble enlace.
3)
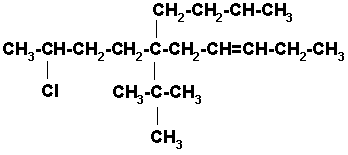
En los compuestos insaturados halogenados, como es el caso de este alqueno, el doble enlace tiene preferencia sobre el halógeno. El carbono del halógeno debe incluirse en la cadena, pero la numeración se inicia por el extremo más cercano al doble enlace, independientemente de la posición del halógeno o los halógenos presentes en la cadena.
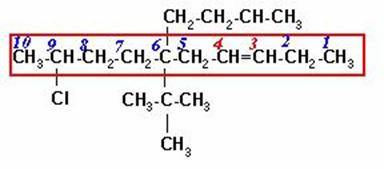
6-n-BUTIL-6-TER-BUTIL-9-CLORO-3-DECENO
4)
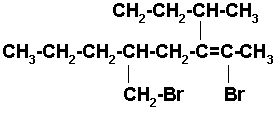
Seleccionamos la cadena más larga que contenga los carbonos unidos al bromo y los carbonos que forman el doble enlace.
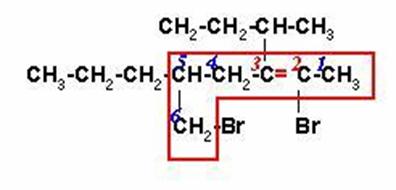
2,6-DIBROMO-3-SEC-BUTIL-5-n-PROPIL-2-HEXENO
5)
Seleccionamos la cadena más larga que contenga los carbonos del doble enlace y numeramos a partir de la derecha que es donde está el doble enlace.
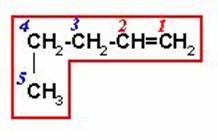
1-PENTENO
EJEMPLOS DE NOMBRE A FORMULA
6)3.4-DIMETIL-2-HEPTENO
La cadena tiene 7 carbonos y el doble enlace está entre los carbonos 2 y 3.
![]()
Colocamos los radicales y completamos los 4 enlaces del carbono con los hidrógenos
7) 1-BROMO-6-SEC-BUTIL-8-CLORO-3-ETIL-4-OCTENO
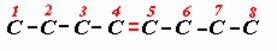
Colocamos los radicales y completamos los hidrógenos
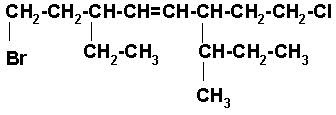
8) 4–CLORO-3-ISOBUTIL-2-n-PROPIL-1-BUTENO
Es una cadena de 4 carbonos con un doble enlace entre los carbonos 1 y 2.
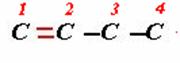
Colocamos los radicales y completamos hidrógenos.
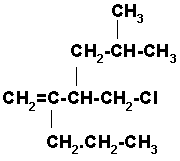
9) 5-SEC-BUTIL-3-TER-BUTIL-6-CLORO-2-HEXENO
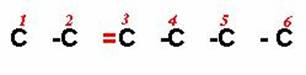
La cadena tiene seis carbonos con un doble enlace entre los carbonos dos y tres. Ahora colocamos los radicales y completamos los 4 enlaces del carbono con hidrógenos.
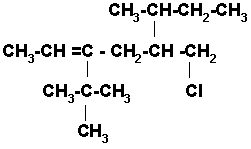
Pregunta: Cuando en una cadena de carbonos hay un doble enlace y un halogeno, por donde se debe iniciar a enumerar:
Cicloalcanos y cicloalquenos
Pese a su diferencia estructural con los hidrocarburos de cadena abierta, las propiedades de los hidrocarburos cíclicos son muy semejantes, por lo que se le conoce también como hidrocarburos alicíclicos (alifáticos cíclicos ) ( ver lección 1: Concepto de hidrocarburos).
CICLOALCANOS
Los cicloalcanos y cicloalquenos forman cadenas cerradas o anillos. Se clasifican en monocíclicos, si constan de un solo anillo. Los monocíclicos no sustituidos ( es decir que no tienen sustituyentes) se nombran agregando el prefijo ciclo al nombre del alcano lineal con el mismo número de átomos de carbono. Ejemplos:
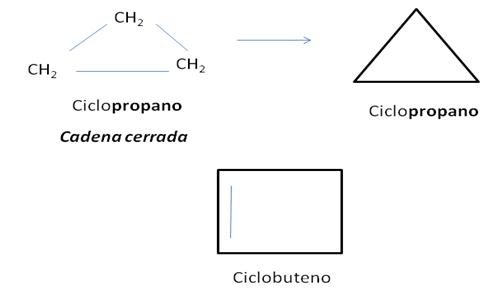
Usualmente estos compuestos (los de cadena cerrada que pueden ser ciclobutano, ciclohexano, cicloctano, ciclobuteno) se representan por su figura geométrica, omitiéndose los átomos de hidrógenos. De esta manera, cada vértice denota un átomo de carbono. (Ver figura arriba)
Cuando existen sustituyentes, el anillo se enumera de tal manera que su posición quede indicada por los localizadores más pequeños posibles. Dichos sustituyentes se enuncian en orden alfabético.

CICLOALQUENOS
Los cicloalquenos son moléculas de fórmula molecular global CnH2n-2. Para nombrar los cicloalquenos se asignan los localizadores 1 y 2 a los carbonos del doble enlace. La dirección de numeración se elige de manera de dar los menores localizadores a los sustituyentes del anillo. Para indicar la posición de ramificaciones u otros enlaces dobles se escoge el sentido de numeración que conduzca a la numeración más pequeña.
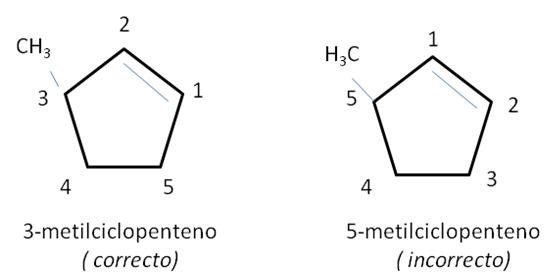
Ya que el doble enlace siempre está en posición 1 no es necesario especificarlo en el nombre
Pregunta. Cuando algún alcano o alqueno se le antepone la palabra ciclo, se indica que:
Los Alquinos
Los alquinos son hidrocarburos insaturados que contienen en su estructura cuando menos un triple enlace carbono-carbono. El enlace triple está compuesto de un enlace fuerte y dos débiles, esto es, uno sigma y dos pi. Estos últimos pueden romperse fácilmente para dar lugar a reacciones de adición.
Los carbonos comprometidos en el enalce triple son digonales, lo que implica que esta parte de las moléculas sea lineal.
![]()
Fórmula general: CnH2n-2
La terminación sistémica de los alquinos es INO.
El más sencillo de los alquinos tiene dos carbonos y su nombre común es acetileno, su nombre sistémico etino.

Propiedades físicas y usos de los alquinos.
- Los tres primeros alquinos son gaseosos en condiciones normales, del cuarto al decimoquinto son líquidos y los que tienen 16 o más átomos de carbono son sólidos.
- La densidad de los alquinos aumenta conforme aumenta el peso molecular.
- Los alquinos como los alquenos, dan reacciones de adición con hidrógeno, halógenos y halogenuros de hidrógeno (haloácidos). Por ejemplo:
Como es de esperarse los alquinos también presentan la reacción de combustión usual de los hidrocarburos y de los compuestos orgánicos en general. El acetileno se enciende en una atmósfera de oxígeno puro produciendo temperaturas extremadamente altas (aproximadamente 3000 ºC). Esta reacción es la base del denominado soplete oxiacetilénico, que se emplea para soldar y cortar metales:
Obtención y usos
Con excepción del acetileno, rara vez se requiere preparar un alquino en la industria o en el laboratorio. El acetileno puede obtenerse fácilmente por reacción entre carburo de calcio y agua.
El acetileno es un importante materia prima industrial y se emplea extensamente en la manufactura de plástico y de otros compuesto químicos, principalmente acetaldehido. Los demás alquinos tienen poco interés industrial. De otro lado, ninguno de ellos participa en la química de los organismos vivos. EL cuerpo humano, por ejemplo, no contiene compuestos con enlaces triples en sus órganos o tejidos.
Pregunta. Los alquinos se caracterizan por:
Nomenclatura de los alquinos
En la selección de la cadena más larga, los carbonos que forman triple enlace, siempre deben formar parte de la cadena principal y la numeración se inicia por el extremo más cercano al enlace triple. Al escribir el nombre de la cadena de acuerdo al número de átomo de carbonos, se antepone el número más chico de los dos átomos con el enlace triple y al final se escribe la terminación INO.
1)
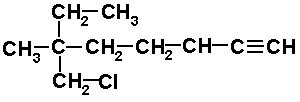
Seleccionamos la cadena continúa más larga que contenga los carbonos con triple enlace, empezando la numeración por el extremo más cercano al triple enlace. Nombramos los radicales en orden alfabético y la longitud de la cadena con terminación INO, anteponiendo el número más pequeño de los carbonos unidos con enlace triple.
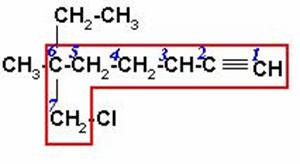
7-CLORO-6-ETIL-6-METIL-1-HEPTINO
3)
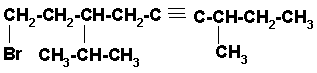
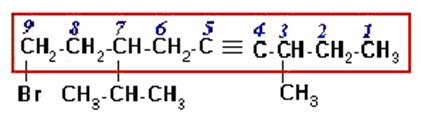
En este caso la cadena continua de carbonos más larga es horizontal y contiene los carbonos del triple enlace y el carbono unido al bromo. El nombre del compuesto es:
9-BROMO-7-ISOPROPIL-3-METIL-4-NONINO
4)
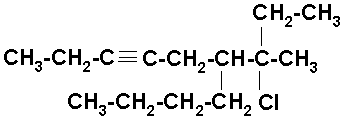
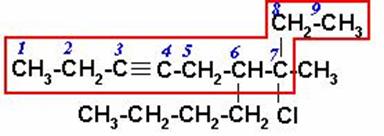
6-n-BUTIL-7-CLORO-7-METIL-3-NONINO
5)
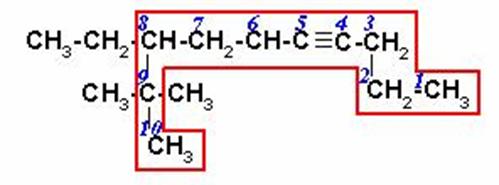
8-ETIL-9,9-DIMETIL-4-DECINO
6)
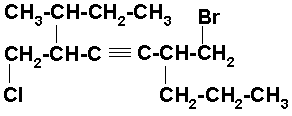
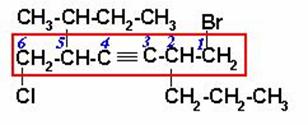
En este caso, el triple enlace está a la misma distancia de ambos extremos, por lo tanto empezamos a numerar por el extremo que tiene el bromo que es de menor orden alfabético que el cloro. El nombre es:
1-BROMO-5-SEC-BUTIL-6-CLORO-2-n-PROPIL3-HEXINO
EJEMPLOS DE NOMBRE A FORMULA
7) 3-n-BUTIL-6-TER-BUTIL-7-YODO-1-OCTINO
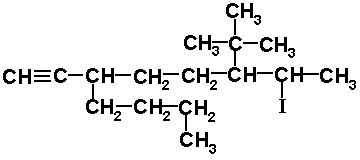
La cadena tiene ocho carbonos. Como el nombre es 1-octino tiene un triple enlace entre los carbonos 1 y 2. Se colocan los radicales en las posiciones señaladas y completamos con hidrógeno para que cada carbono tenga 4 enlaces.
8) 9-BROMO-9-CLORO-5-ISOBUTIL-7-ISOPROPIL2-METIL-3- DECINO

9) 1-BROMO-5-n-BUTIL-7-CLORO-7-METIL-1-NONINO
Es una cadena de nueve carbonos con un triple enlace entre los carbonos 1 y 2.
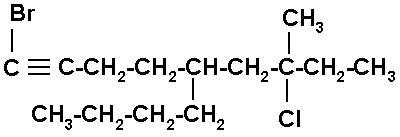
10) 7-CLORO-6-ETIL-6-ISOPROPIL-2-YODO-3-HEPTINO
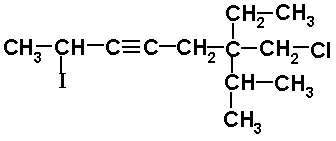
La cadena tiene 7 átomos de carbono con un triple enlace en los carbonos 3 y 4. Recuerde que siempre se utiliza para indicar la posición del número más pequeño. Una posición 4, por ejemplo, indicaría que el triple enlace está entre 4 y 5.
NOTA: Si hay más de un doble o triple enlace, las terminaciones son: adieno (2 dobles enlaces), atrieno (3 dobles enlaces), adiino (2 triples enlaces), atriino (3 triples enlaces), enino (un doble enlace y un triple enlace), adienino (2 dobles enlaces y un triple enlace), enodiino (un doble enlace y dos triple enlaces), etc.
Ejemplo:
1,2-petadieno-4-ino
![]()
PREGUNTA: ¿Cuál sería el nombre que le correspondería a la siguiente estructura?
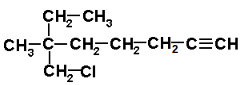
6-clorometano-6-metil-1-octino.
6-clorometano-6-etil-1-heptino.
7-cloro-6-etil-6-metil-1-heptino.
Todas las
anteriores.
Clases de Reacciones en general
A lo largo de la unidad hemos encontrado diferentes modalidades de reacciones que realizan los hidrocarburos (y los compuestos orgánicos en general), por lo que conviene, antes de finalizar, reunirlas para su mejor comprensión:
Las principales clases de reacciones de los compuestos orgánicos son las siguientes:
Reacciones de sustitución o desplazamiento: Un átomo o grupo de átomos de una molécula o ion es remplazado por otro átomo o grupo:
Estas reacciones, como vimos son características de los alcanos, pero también las presentan los hidrocarburos aromáticos, los ácidos y otras funciones orgánicas.
Reacciones de adición: son aquellas en las que un reactivo se adhiere a un compuesto, generalmente con ruptura de un enlace pi , para formar un nuevo compuesto.
Son reacciones típicas de los hidrocarburos insaturados, aunque también la presentan los aldehídos y otras funciones.
Reacciones de eliminación: Son justamente las inversas de la adición. En ellas, dos átomos o grupos unidos a sendos aromos de carbono del sustrato se desprenden y se combinan para formar una molécula sencilla:
Son reacciones muy comunes de los derivados halogenados de alcanos, pero también la presentan los alcoholes y otras clases de compuestos.
Reacciones de oxidorreducción: Como sabemos, son aquellas en las que se producen cambios en el estado de oxidación de, por los menos, dos de las especies participantes. La combustión es la mas común de estas reacciones y obedece a la siguiente ecuación general
(Sin balancear)
Reacción acido-base: como su nombre lo indica, son reacciones que dan entre especies de propiedades ácidas y básicas. El ácido le cede hidrogeniones (protones) a la base, de tal manera que se forman el catión de ésta y el anión del ácido, a saber:
HA + B ------------ HB+ + A-
Entre los compuestos orgánicos actúan como ácidos los ácidos carboxílicos pero también los fenoles, los alcoholes (ácidos sumamente de débiles) y otras funciones menores. Entre los compuestos de carácter básico se destacan las aminas.
Pregunta. Las reacciones de eliminación se presentan en:
Hidrocarburos Aromaticos
Los hidrcarburos aromáticos son aquellos hidrocarburos que poseen las propiedades especiales asociadas con el núcleo o anillo del benceno, en el cual hay seis grupos de carbono-hidrógeno unidos a cada uno de los vértices de un hexágono. Entre los hidrocarburos aromáticos se encuentran el benceno, el tolueno, el antraceno y el naftaleno.
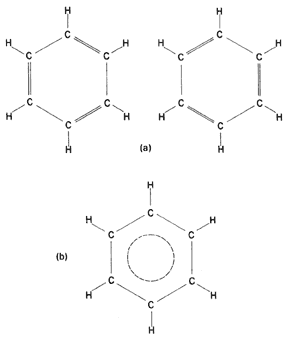
Estructura del benceno
En general, podemos decir que los compuestos aromáticos están constituidos por el benceno y todos aquellos compuestos que presentan un comportamiento químico similar y que dan lugar a la serie aromática, la cual se construye a partir del benceno, fundamentalmente de dos formas:
1.- Mediante la simple sustitución de los átomos de hidrógeno del núcleo bencénico por otros sustituyentes (bencenos sustituidos).
2.- Mediante la unión de uno o más anillos adicionales (aromáticos o no), con sustituyentes o no, a una o más posiciones del anillo bencénico progenitor (derivados aromáticos polinucleares).
El derivado más simple del benceno es el tolueno (metilbenceno) en el que uno de los átomos de hidrógeno se ha sustituído por un grupo metilo.
Los compuestos aromáticos pueden estar formados por varios ciclos a la vez, dando una gran variedad de estructuras. Así, la fusión de dos anillos bencénicos da lugar al naftaleno, en el cual podemos ver también la coplanaridad de todos sus átomos. Pueden fusionarse más anillos, dando lugar a estructuras como el antraceno y el fenantreno, (ambos con tres anillos); y un caso particularmente interesante es el kekuleno, con doce anillos unidos formando un sistema hexagonal, totalmente plano y con todos sus electrones pi deslocalizados. Puede comprobarse la coplanaridad rotando la molécula. Recibe este nombre en honor de Kekulé, químico alemán a quien se debe la propuesta de estructura del benceno.
Pregunta. Los hidrocarburos aromáticos están formados principalmente por:
ENTRE A ESTE LINK Y PRACTICA hIDROCARBUROS AROMATICOS
http://www.alonsoformula.com/organica/aromaticos.htm
Taller. Alcanos, Alquenos y Alquinos
1. ¿Cuáles son las principales fuentes naturales de los alcanos?
2. Explica: por qué se llama también a los alcanos, como hidrocarburos saturados.
3. Escribe la estructura correcta para cada uno de los siguientes nombres.
2,3-DIMETILBUTANO
2-METILBUTANO
4-ETIL-5-ISOPROPIL-2,2-DIMETILOCTANO
3,5-DIETIL-4-ISOPROPILHEPTANO
5-ETIL-4-ISOPROPIL-2-METILOCTANO
2-BROMO-3-METILBUTANO
2,2,4-TRIMETILPENTANO
3,5,6 – TRIETIL- 4 – ISOPROPILNONANO
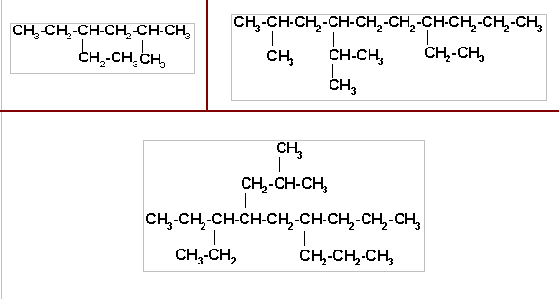
4. Señale la cadena principal, su numeración y escriba el nombre correcto para cada estructura.
5. Escriba la estructura que corresponda a los siguientes nombres. Indique entre paréntesis si es un alqueno o un alquino.
2-METIL-2-BUTENO
4-ETIL-3-n-PROPIL-1-OCTENO
2,7-DIBROMO-5-SEC-BUTIL-3-HEPTINO
3-ISOPROPIL-5-METIL-1-HEXINO
3-TER-BUTIL-2-CLORO-5-ISOPROPIL-4-NONENO
5-ETIL-5-ISOBUTIL-3-OCTINO
2,3,3,4-TETRAMETIL-1-PENTENO
2-BROMO-6-n-BUTIL-5-TER-BUTIL-2-DECENO
1-BROMO -2-BUTINO
2,5-DIMETIL-3-HEXENO
3-ISOPROPILHEXENO
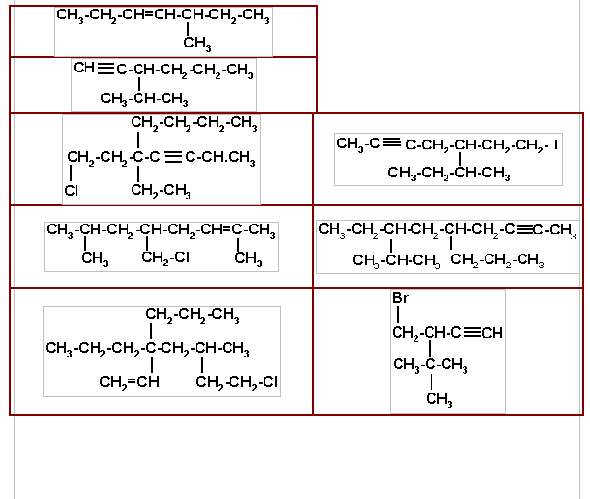
6. Escriba el nombre que corresponda las siguientes estructuras. Señale la cadena principal y su numeración. Indique entre paréntesis si el compuestos es un alqueno un alquino.
7. Escribe las formulas estructurales de los siguientes compuestos: Debe hacer las figuras (en Word o en Paint) no bajarlas por Internet.
4- fenil -3-metil-2-penteno
1-2- dibromo-1,2-difeniletano
2-cloro-3-yodoestireno
Ácido 2,5-dicloro 3-nitrobenzoico
Naftaleno
m- dinitrobenceno
3,5-dimetiltolueno
Tolueno
3, 4,5- tribromofenol.
INTRODUCCIÓN (EL PETROLEO)
El petróleo (del griego, petrus: piedar y oleum: aceite) es una mezcla compleja de numerosos hidrocarburos líquidos y sólidos, que pueden alcanzar hasta 50 átomos de carbono por molécula.
Su importancia en la época moderna es innegable. Basta considerar que es la principal fuente de combustible para todo tipo de transporte. Pero además, muchas otras industrias dependen en buena parte del petróleo: caucho, plástico, insecticidas, pavimentos, drogas, pinturas, abonos, solventes y muchos otros materiales son posibles gracias a la industria petroquímica.
HISTORIA
El petróleo y sus productos fueron conocidos y utilizados desde tiempos muy remotos. Los informes más antiguos acerca del uso del petróleo indican hacia el año 3000 a.c. Los habitantes de Mesopotamia empleaban el asfalto para pavimentar vías, para impermeabilizar barcos y canales y para construir adobes. Mezclándolo con arena y fibras.
La Biblia nos cuenta que Noé utilizo brea para calafatear su arca por dentro y por fuera. Los egipcios usaron el petróleo para preservar sus difuntos , para pavimentar sus vías , para lubricar las ruedas y los ejes de sus carros , y como combustible de guerra.
Los griegos, posteriormente los romanos, emplearon como arma de combate una mezcla de azufre, salitre, resinas y petróleo que se hizo famosa con el nombre de fuego griego.
Un gran avance en la industria petroquímica se debe a los árabes, quienes alrededor del año 1000 a.c destilaron petróleo para obtener queroseno y utilizarlo para la iluminación.
Los usos del petróleo fueron más bien triviales hasta principios del siglo XIX, cuando el gran desarrollo ocasionado por la revolución industrial hizo necesaria la búsqueda de nuevos combustibles, especialmente para la iluminación. Por entonces se utilizaban con tal fin aceite de ballena, tarentina, aceite de hulla, grasas y otros minerales afines.
Ante la creciente demanda de combustible, se hicieron amplios estudios sobre la composición del petróleo y, en 1859, Edwin L. Drake perforo el primer pozo petrolero, en Titusville, Pensilvania EE.UU).
El petróleo se destilo entonces para obtener un fracción de hidrocarburos de alrededor de 8 a 16 carbono por molécula (Llamada queroseno), que tuvo gran aplicación como combustible para la iluminación. La fracción más volátil, que contenía compuestos de 5 a 12 carbonos (llamada nafta) encontró uso como solvente, principalmente de pinturas. No se conocía por aquella época el motor de combustión, así que mucha parte de esta nafta (o gasolina) sobraba y era botada a los ríos. La fracción más pesada se empleó como lubricantes y para pavimentar las calles. Al principio del presente siglo, la aparición del automóvil constituyo un impulso adicional para la creciente demanda por el petróleo , ya que la nafta o gasolina resulto ser la fracción más adecuada como combustible para dichos vehículos.
Desde entonces la industria petroquímica se ha desarrollado a pasos agigantados , no solo en cuanto a los métodos de obtención y refinación del petróleo , sino también por el número cada vez mayor de productos que se manufacturan con base en derivados de tan inevitable recurso natural.
Pregunta . Este movimiento permitió el descubrimiento de nuevos formas del petróleo util para la iluminación:
ORIGEN Y ESTADO NATURAL
La teoría más aceptada en la actualidad acerca del origen del petróleo indica que este proviene de la descomposición de materia animal y vegetal de origen marino, merced a la acción de microorganismos anaeróbicos. Este proceso ocurrió en épocas sumamente remotas, quizás tanto como 500 millones de años. Se ha encontrado que los depósitos de petróleo mas reciente se formaron hace por lo menos 50 millones de años.
El petróleo se encuentra en acumulación en el subsuelo, en terrenos sedimentarios de origen marino, aprisionado entre capas impermeables y embebidas en capas porosas (principalmente de arenisca), junto con gases y agua salina.
GAS NATURAL Y GAS LICUADO DEL PETROLEO
El gas natural
Se conoce como gas natural la mezcla de hidrocarburos gaseosos que acompaña normalmente al petróleo liquido. El gas natural, de extensa utilización como combustible domestico e industrial, esta constituido esencialmente por metano, con menores proporciones de otros alcanos de bajo peso molecular. Su composición varía según el lugar de donde se obtenga. En algunos casos se presentan altas proporciones de dioxido de carbono (hasta un 30 %), nitrógeno, sulfuro de hidrógeno y helio. Dichos gases son removidos casi en su totalidad antes de vender el gas natural para uso como combustible.
El gas licuado del petróleo
Ciertos hidrocarburos gaseosos de bajo peso molecular se encuentran disueltos en el petróleo crudo, y se producen también como subproductos de la manufactura de la gasolina. Estos hidrocarburos de bajo peso molecular – esencialmente propano- después de ser removidos por destilación, se licuan por comprensión y se envasan en cilindros de acero para ser utilizados como combustible domestico con el nombre de gas licuado del petróleo ( GLP), gas de cocina de o , simplemente, propano. El gas licuado pasa nuevamente al estado gaseoso cuando alivia la presión al abrir la llave del cilindro.
PREGUNTA. El principal componente del gas natural es:
COMPOSICIÓN DEL CRUDO
La composición del petróleo crudo varía ampliamente según su fuente, pero en todos los casos sus principales componentes son los hidrocarburos saturados. Se presentan también altas proporciones de hidrocarburos aromáticos e igualmente pequeñas cantidades de compuestos oxigenados y sulfurados. Se considera que son el orden de cincuenta a ochenta mil los compuestos diferentes que hacen parte de los petróleos comunes.
El numero de compuestos que conforman un crudo en particular es así mismo sumamente grande, por lo cual resulta difícil determinar la composición exacta de un muestra.
En una muestra de crudo se lograron identificar 295 compuestos diferentes, los cuales, en total representan cerca de un 50 % por volumen de la muestra. El otro 50 % contenía aquellos compuestos que no pudieron ser identificados, ya sea por su complejidad o por encontrarse en proporciones extremadamente pequeñas.
EXPLORACIÓN Y EXPLOTACIÓN
El primer paso en la obtención del petróleo es la exploración de los yacimientos. Cuando los análisis geológicos y paleontológicos indican que una determinada región puede ser apta para la producción de petróleo, se inicia una serie de estudios más detallados del subsuelo , la cual incluye análisis sismográficos, petrográficos, geofísicos, etc.
Si los resultados de estos estudios muestran buenas probabilidades de existencia de petróleo en el lugar, se procede a la perforación de pozos de prueba, que en gran número de oportunidades resultan improductivos a pesar de todos los indicios en contra.
La explotación de los yacimientos petrolíferos implica la perforación de los pozos y la extracción del crudo . la perforación de un pozo es un proceso complejo , para lo cual se hace necesario la construcción de un gran torre de acero , que facilita las operaciones . Si la presión de los gases en el yacimiento es alta , el crudo puede ascender directamente por el pozo ; de otra manera , hay que utilizar bombas impulsoras o inyectar gas a presión.
El crudo que se extrae del pozo pasa a una planta en donde se separa del gas natural y se despoja del agua y de la sal que contenga.
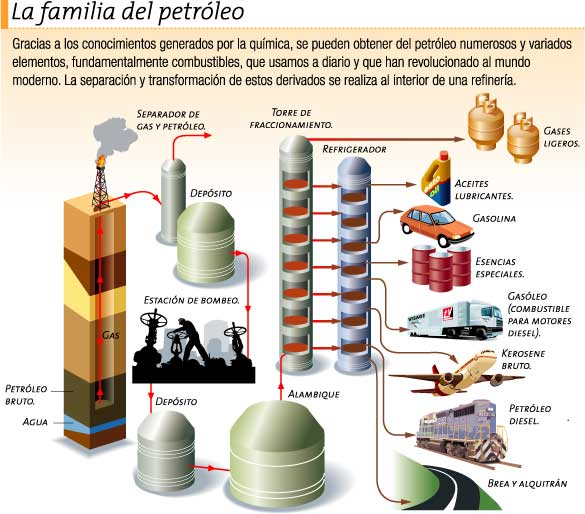
PREGUNTA: ¿Cuál es el principal componente del petróleo crudo?
DESTILACIÓN PRIMARIA DEL PETROLEO
El petróleo crudo no tiene casi ninguna aplicación, por lo cual después de las operaciones preliminares antes citadas, se somete a procesos de destilación y de refinación para obtener fracciones o productos de mayor utilidad. Todas estas operaciones se realizan en las denominadas refinerías.
La primera operación que se verifica en una refinería es una destilación fraccionada que se lleva a cabo en grandes torres y que se separa el petróleo en varias fracciones.
LA GASOLINA
La gasolina es el subproducto más importante del petróleo. Esta constituida fundamentalmente por hidrocarburos alifáticos de cadena abierta cuyo número de carbono varia entre 5 y 12, y por cicloalcanos. Los principales componentes son n-hexano, n-heptano, n-octano y sus isómeros.
La gasolina obtenida directamente por destilación del crudo se refina para eliminarle las impurezas sulfuradas (compuestos de azufre) que contengan, ya dichas impurezas le disminuyen su capacidad combustible. Aun así, esta gasolina, que se conoce como gasolina de destilación directa, solo representa el 10% del total de la producción mundial. El resto se obtiene mediante procesos que parten de otras fracciones del petróleo, como son el craqueo y la alquilación.
Craqueo o cracking
Se conoce como tal la descomposición térmica o pirolisis de hidrocarburos de alto peso molecular (no adecuados como combustible) en moléculas mas pequeñas. El proceso se realiza a temperaturas del orden de 500 a 600 ºC, usualmente en presencia de catalizadores.
La fracción que corrientemente se somete a craqueo es el gasóleo o gas oil y en el proceso se obtienen no solo hidrocarburos componentes de la gasolina, sino también muchos otros que se emplean como materia prima en la manufactura de plásticos, drogas, detergentes, etc.
Alquilación
Aunque no tan importante como el craqueo, la alquilación es también un proceso muy utilizado para obtener gasolina. Consiste esencialmente en la reacción de alquenos menores con isobutano, para lograr hidrocarburos líquidos que estén en el intervalo de los componentes de la gasolina.
Pregunta. A la descomposición térmica se le conoce como:
Alcoholes, Fenoles y Eteres
En esta parte desarrollaremos paralelamente los acoholes y los fenoles, dada la similitud en muchas de sus reacciones, con preferencia en el estudio de los alcoholes. Los eteres se trataran brevemente al final.
Alcoholes
Los alcoholes son el grupo de compuestos químicos que resultan de la sustitución de uno o varios átomos de hidrógeno (H) por grupos hidroxilo (-OH), que como sabemos, es el grupo funcional de tales compuestos. Por ejemplo:
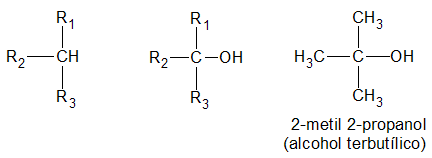
Según el oxígeno esta unido a un carbono primario, a uno secundario o uno terciario, se distinguen tres clases de alcoholes de igual denominación:
Alcohol Primario
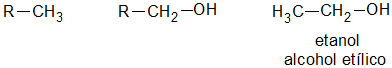
Alcohol Secundario
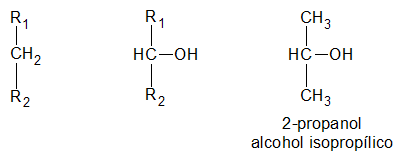
Alcohol Terciario
En los alcoholes, el carbono y el oxigeno enlazados entre si ( C-O) presentan hibridación sp3, de tal manera que dicho enlace es de tipo sigma. También lo es el enlace OH y, por supuesto los enlaces carbono-carbono.
Los fenoles por su parte, pueden considerarse como derivados de los hidrocarburos aromáticos , cuando el hidrógeno reemplazado hace parte del anillo , como se destaca a continuación:
Propiedades físicas de los alcoholes y fenoles
Los alcoholes primarios y secundarios de hasta diez átomos de carbono son líquidos incoloros de ahí en adelante son sólidos, al igual de los fenoles. Los de menor peso molecular son soluble en agua, lo que se explica por la gran afinidad que existen entre las moléculas del agua y las de alcohol, afinidad que se refuerza por el establecimiento de puentes de hidrógeno entre ellas.
Los puentes de hidrógenos, consisten en que el hidrógeno forma un puente entre dos átomos pequeños pero de alta electronegatividad. En el agua y los alcoholes estos son de oxigeno.
Los puntos de ebullición de los alcoholes son excepcionalmente elevados en comparación con los de los hidrocarburos de peso molecular semejante. Este hecho se explica igualmente por la formación de puentes de hidrógenos.
El fenol por su parte es mucho mas soluble en agua de los se esperaría de un alcohol de seis carbonos. En efecto su solubilidad es de 6.3 g/ml, cundo la del ciclohexanol es de 3.6 g/ml y la de n-hexanol apenas alcanza a 0.6 g/ml. Tan notable solubilidad del fenol se debe a su forma compacta y, mas que todo . a los enlaces de hidrógeno particularmente fuertes que establece con las moléculas de agua.
Pregunta. Los fenoles se obtienen a partir de:
REPASO DE ALCOHOLES Y FENOLES ENTRE A ESTE LINK
http://www.alonsoformula.com/organica/alcohois.htm
Los éteres
Los éteres son compuestos de formula general R – O – R , en los cuales los átomos de oxígeno se presentan unido a dos grupos alquílicos o arílicos. El nombre de los éteres consta de la palabra éter seguida de los grupos presentes y el sufijo ico. Si ambos grupos son iguales, se puede emplear el prefijo di, pero no es obligatorio.
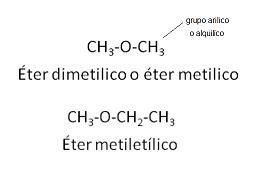
Isomería del grupo funcional
Los alcoholes saturados son isómeros estructurales de los éteres de igual número de carbonos.
Propiedades de los éteres
Como todos los hidrógenos de un éter están unidos a átomos de carbono y no al de oxigeno (cosa que ocurre en el OH de los alcoholes), las moléculas de los éteres no forman puentes de hidrógeno entre si; por consiguiente, los puntos de ebullición de los éteres son comparativamente menores que los de los alcoholes. Por ejemplo, el éter etílico ebulle a 35 º C, en tanto que el 1- butanol, su isómero, lo hace a 117,3 º C.
No obstante los éteres si pueden formar puentes de hidrógeno con el agua, lo que explica el que, como los alcoholes, sean altamente solubles en tal solvente. Así tanto el éter etílico como el 1-butanol tienen solubilidad de 8/100 L mL de agua.
Los éteres, sobre todo los miembros menores, son sumamente volátiles e inflamables. A diferencia de los alcoholes, los éteres presentan muy poca reactividad química.
El éter etílico o simplemente éter, es el compuesto más importante de la serie. Es un excelente solvente orgánico y un magnifico anestésico. Su alta inflamabilidad, no obstante, representa un peligro en el laboratorio y en las salas de cirugías, por lo cual debe manejarse con extremo cuidado.
Pregunta. Los puntos de ebullición de los eteres son menores que el de los alcoholes por que:
ENTRE A ESTE LINK PARA ESTUDIAR LOS ESTERES
http://www.alonsoformula.com/organica/eteres.htm
Aldehidos y cetonas
EL GRUPO CARBONILO
Los aldehídos y las cetonas se caracterizan por la presencia del grupo funcional conocido como grupo carbonilo, el cual imparte propiedades muy similares.
En los aldehídos, el grupo carbonilo ocurre en un extremo de la cadena, en tanto que en las cetonas se presentan en uno de los carbonos intermedios; lo que conduce a las siguientes formulas generales:
Por consiguiente, los aldehídos y las cetonas de igual número de carbonos son isòmeros. Por ejemplo:
Es de destacar que en los aldehídos el grupo carbonilo esta unido a un carbono y a un hidrógeno, en tanto que en las cetonas, lo esta a dos carbono. En el metanal o formaldehído, como caso excepcional, dicho grupo esta unido a dos átomos de hidrógeno:
El átomo de carbono del carbonilo esta hibridado trigonalmente y, por tanto, dispone de tres orbitales sp2 coplanares y separados por ángulos de
El grupo carbonilo tiene, así, una geometría similar a la del doble enlace carbono- carbono, pero con una notable diferencia: las electronegatividades de los átomos comprometidos en el carbonilo son distintas , siendo la del oxigeno ( 3,5) considerablemente mayor que la del carbono ( 2,5) . Esto hace que la nuble electrónica , sobre todo la originada por el orbital pi , sea atraída fuertemente hacia el oxigeno , que se convierte , entonces en un polo negativo; el carbono, al quedar desabastecido parcialmente de electrones, constituye el polo positivo.
Esta descripción, como sabemos es la de un enlace polar, según se representa a continuación de dos maneras diferentes:
El grupo carbonilo se halla en un altísimo número de compuestos orgánicos que se encuentran en la naturaleza, entre los cuales se incluye proteínas, carbohidratos, ácidos nucleicos y grasas.
Ocurre igualmente en gran parte en los compuestos orgánicos sintéticos, especialmente en plásticos, resinas y otros polímeros.
PREGUNTA. En los aldehidos el grupo carbonilo se ubica en:
a dos atomos de hidrogeno
en los carbonos intermedios
en el extremo de la cadena carbonada
Reacciones de los aldehidos y cetonas
La presencia del grupo carbonilo, tanto en los aldehídos como en las cetonas , hace que las reacciones entre estos dos tipos de compuestos sean muy similares. Sin embargo, los aldehídos exhiben una reactividad un poco mayor debido a la ubicación extrema del grupo carbonilo.
Reacciones de adición
La reacción global tanto para aldehídos como para cetonas es:
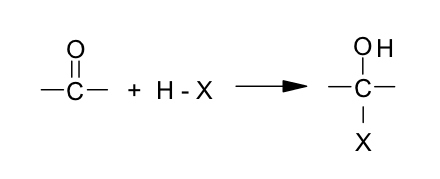
Esta reacción permite a los aldehídos y cetonas adicionar agua para formar hidratos, ácido cianhídrico para formar cianhidrinas, alcoholes para formar hemiacetales o hemicetales y bisulfito de sodio, entre otros.
Mecanismo de adición nucleófila: la parte nucleófila del reactivo choca con el carbono carbonilo, rompe el enlace pi desplazándose los electrones hacia el oxígeno y originándose un intermediario bipolar de la siguiente manera
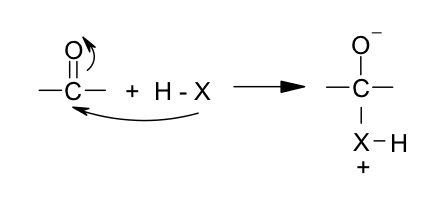
El enlace X – H del intermediario estará muy polarizado debido a la carga positiva sobre X y tenderá a perder el ión hidrógeno, el átomo de oxígeno cargado negativamente será básico y adquirirá el ión hidrógeno, así:
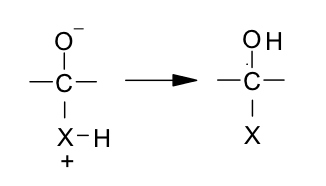
Son muchos los reactivos que pueden adicionarse la grupo carbonilo para dar reacciones que tienen gran importancia en al síntesis orgánica. Aquí solo consideraremos una de ellas, la adición de alcoholes, que nos ayudara posteriormente a comprender la estructura cíclica de los azucares.
Adición de alcoholes: La producen tanto los aldehídos como las acetonas y es catalizada por ácidos minerales. En el primer caso se producen hemiacetales, mientras que con las acetonas se forman hemicetales:
Como se observa, el nucleòfilo es el grupo alcoxi, RO:- , que proviene de la ruptura heterolìtica del enlace O-H del alcohol; el otro producto de dicha ruptura es el protòn H+ , que actúa como electròfilo.
Por otra parte, los hemiacetales y hemicetales se caracterizan por tener un grupo OH y un grupo OR sobre el mismo carbono, las otras dos valencias están satisfechas por un hidrogeno y un grupo alquìlico en los hemiacetales , o por dos grupos alquìlicos en los hemicetales.
Veamos dos ejemplo:
Reacciones de Oxidación
Hemos visto que los alcoholes se oxidan a aldehídos, que los hidrocarburos se oxidan por combustión y forman CO2 y agua.
Que los aldehídos y cetonas se reducen para producir alcoholes, y otras tantas reacciones similares. Pero es posible que no este lo suficientemente claro el significado de los términos oxidación y reducción en cada caso.
Por tal motivo, antes de continuar con las reacciones de los aldehídos, conviene examinar lo que son las series de oxidación y reducción en los compuestos orgánicos, En términos simples una de tales series se construye organizando las funciones de acuerdo al aumento o disminución del numero de oxidación de carbono . Un ejemplo se ilustra a continuación, para compuestos de dos carbonos de las funciones que hemos estudiado continuación.
Oxidación
| Funciones | Alcanos | Alcoholes | Aldehídos | Ácidos |
| Formula estructural | CH3 – CH6 | CH3-CH2OH | CH3 – CHO | CH3-COOH |
| Formula molecular | C2H6 | C2H6O | C2H4O | C2H4O2 |
| Nombre | Etano | Etanol | Etanal | Acido etanoico |
| No de Oxdn. del carbono | -3 | -2 | -1 | 0 |
Así, pasamos de un alcohol a un aldehído o a un acido, es una oxidación, pero el cambio contrario es una reducción.
Vale la pena advertir que la posición de los aldehídos se aplica también a sus isòmeros , las cetonas y que el máximo estado de oxidación del carbono es +4 en el CO2 que no se incluye en la figura .
Obviamente, en cada reacción individual de oxidación del haber otro reactivo que se reduce, comúnmente un agente oxidante como oxigeno , permanganato de potasio y otros compuestos inorgánicos. Lo que sucede es que estos cambios no se hacen explícitos, ya que la atención se centra en el comportamiento de los compuestos orgánicos. Lo mismo ocurre para las reacciones de reducción.
Ahora si volvamos al tema que nos ocupa . Los aldehídos se oxidan fácilmente y forman ácidos carboxílicos mediante oxidantes comunes como soluciones de permanganato de potasio o dicromoto de potasio en acido sulfúrico diluido:
Las cetonas , por el contrario, no evidencian este tipo de reacciones, lo que da origen a algunas pruebas de laboratorio que sirven para distinguirlas de los aldehídos . Las más utilizadas son las pruebas de Tollens y de Fehling.
Prueba de Tollens : El reactivo de Tollens es esencialmente una solución de nitrato de plata en hidróxido de amonio, de cuya mezcla se forma un ion conocido como diaminoplata Ag(NH3)2+ Este ion, por la acción del aldehído , se reduce a la plata metálica , la cual se deposita en las paredes del recipiente , a manera de un espejo de plata.
La prueba de Tollens es positiva (confirmación del espejo de palta) tanto para aldehídos alifáticos como para aromáticos. Las cetonas, según se indico, dan resultado negativo.
Prueba de Fehling : El reactivo de fehling consta de dos soluciones , una sulfato de cobre (II) y la otra tartrato de sodio y de potasio en un medio alcalino. Al mezclar estas dos soluciones, se forma un tartrato complejo que contiene el ion cobre (II) de color azul intenso.
La adición del aldehído reduce el ion cobre (II), formándose un precipitado de oxido de cobre (I), de color ladrillo.
La prueba de Fehling es positiva (cambio de color de azul a ladrillo) para aldehídos alifáticos pero no para aromáticos, lo que permite distinguir entre estas dos clases de aldehídos.
Reacciones de reducción
Los aldehídos pueden ser reducidos a alcoholes primarios y las cetonas a alcoholes secundarios, reaccion que ya se estudió en la lección de los alcoholes ,como método de obtención de alcoholes. El agente reductor más empleado es el borhidruro de sodio, NaBH4 .
A manera de repaso, veamos nuevamente la ecuación general:
Por ejemplo
PREGUNTA . ¿Cuando se considera positiva la prueba de fehling'
ENTRE A ESTE LINK PARA ESTUDIO DE CETONAS
http://www.alonsoformula.com/organica/cetonas.htm



Comentarios
Publicar un comentario